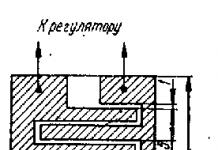
По мере развития количество клеток, из которых состоит зародыш, увеличивается. Деления клеток (дробление яйца) на самых ранних стадиях развития происходят равномерно (синхронно). Ho у одних видов раньше, у других позже эта синхронность нарушается и клетки, из которых образуются зачатки разных органов, начинают делиться с разной скоростью. Эти различия в скорости деления можно рассматривать как одно из первых проявлений их дифференцировки.
У зародышей млекопитающих уже после стадии 16–32 бластомеров большая часть клеток начинает делиться быстрее и образует трофобласт – зачаток будущей плаценты. Сам будущий зародыш состоит на этих ранних стадиях всего из нескольких клеток. Однако позже в ходе развития и роста зародыш и затем плод становятся во много раз больше плаценты.
У амфибий на стадии бластулы, состоящей из нескольких тысяч клеток, будущая мезодерма составляет менее одной трети всех клеток. Ho по мере развития мезодермальные производные – все мышцы, почти весь скелет, система кровообращения, почки и др. – занимают не менее 80 % всей массы головастика.
Особенно нагляден неодинаковый темп деления клеток в морфогенезе многих беспозвоночных. У видов с мозаичным развитием уже на стадии 30–60 клеток зачатки всех основных органов определены и представлены очень немногими клетками (иногда всего двумя). Далее деления клеток в каждом зачатке строго программируются. Так, например, ранний зародыш асцидий содержит 52 клетки эктодермы, 10 клеток энтодермы и всего 8 клеток мезодермы. В течение последующего развития число клеток эктодермы возрастает в 16 раз, энтодермы – в 20, а мезодермы – в 50. Благодаря программированности делений число клеток у некоторых взрослых беспозвоночных (например, у нематод) строго постоянно и каждый орган представлен определенным числом клеток. Далеко не всегда местоположение органа и место, где делятся составляющие его клетки, совпадают. Часто митозы происходят только в особой зоне размножения и оттуда клетки мигрируют к месту своей дифференцировки. Примеры такого рода мы уже видели при рассмотрении системы стволовых клеток. То же происходит, например, и при развитии головного мозга.
Программа клеточных делений не всегда очень строга и предопределяет точное их число. Чаще, вероятно, деления происходят до тех пор, пока количество клеток или размер органа не достигнет определенной величины. Речь идет, таким образом, о двух принципиально различных механизмах регуляции клеточных делений.
В одном случае (как в яйцах с мозаичным развитием) он, по‑видимому, заключен в самой делящейся клетке, которая должна «уметь отсчитывать» свои деления. В другом же случае должна существовать некоторая «петля обратной связи», когда масса органа или число клеток, достигая некоторой величины, начинает тормозить дальнейшие деления.
Оказалось, что число делений в нормальных клетках, не трансформированных в злокачественные, вообще не беспредельно и обычно не превышает 50–60 (большинство клеток делится меньше, так как если бы яйцо равномерно разделилось 60 раз, то число клеток в организме (260) оказалось бы в тысячи раз выше, чем в действительности). Однако ни механизм такого предела числа клеточных делений (называемого по имени открывшего его ученого предел Хайфлика), ни его биологический смысл пока непонятен.
Что же является «датчиком» в системе регуляции – размер органа или число клеток? Однозначный ответ на этот вопрос дают опыты с получением животных с измененной плоидностью – гаплоидные, триплоидные или тетраплоидные. Их клетки соответственно в 2 раза меньше или в 1,5 или 2 раза больше нормальных диплоидных. Тем не менее и размер самих животных, и размер их органов, как правило, нормальные, т. е. они содержат больше или меньше клеток, чем в норме. Регулируемой величиной, следовательно, является не количество клеток, а масса органа или всего организма.
Иначе обстоит дело у растений. Клетки тетраплоидных растений, как и у животных, соответственно больше диплоидных. Но и размеры частей тетраплоидных растений – листьев, цветков, семян – часто оказываются больше обычных почти в 2 раза. Похоже, что у растений «датчиком» при определении числа клеточных делений является не размер органа, а само число клеток.
Механизмы, регулирующие клеточные деления – пролиферацию клеток, изучаются очень интенсивно и с разных сторон. Одним из стимулов такой активности ученых является то, что отличия раковых клеток от нормальных во многом и состоят в нарушении регуляции клеточных делений, в выходе клеток из‑под такой регуляции.
Примером одного из механизмов регуляции клеточных делений может служить поведение клеток, посеянных на дно флакона с питательной средой, – клеточной культуры. Их деления в хороших условиях происходят до тех пор, пока они не покроют все дно и клетки не коснутся друг друга. Далее наступает так называемое контактное торможение, или торможение, зависимое от плотности клеток. Его можно нарушить, как это делал Ю. М. Васильев, расчистив от клеток небольшое окошко на поверхности стекла. В это окошко со всех сторон устремляются клетки, вокруг него проходит волна клеточных делений. Можно думать, что и в организме контакты с соседними клетками являются механизмом, сдерживающим клеточные деления.
У опухолевых клеток эта регуляция нарушается – они не подчиняются контактному торможению, а продолжают делиться, громоздясь друг на друга. Аналогично, увы, они ведут себя и в организме.
Ho контактное торможение не является единственным механизмом регуляции: ее барьер может быть преодолен и у вполне нормальных клеток. Так, например, плотно прижатые друг к другу клетки печени у молодого животного тем не менее делятся и печень растет вместе с ростом всего животного. У взрослых животных эти деления практически прекращаются. Однако если две доли печени удалить, то в оставшейся доле очень быстро начнутся массовые деления клеток – регенерация печени. Если удалить одну почку, то в течение немногих дней вторая почка за счет клеточных делений увеличится вдвое. Очевидно, что в организме существуют механизмы, способные стимулировать клеточные деления в органе, активировать его рост и приводить размеры органа тем самым в некоторое количественное соответствие с размерами всего организма.
В этом случае действуют не контактные механизмы, а какие‑то химические факторы, может быть связанные с функцией печени или почек. Можно представить, что недостаточность функции этих органов, при удалении части их или при отставании их роста от роста всего организма, так нарушает весь метаболизм в организме, что это вызывает компенсаторную стимуляцию клеточных делений именно в данных органах. Есть и другие гипотезы, объясняющие, например, подобные явления действием особых ингибиторов клеточных делений – кейлонов, выделяемых самим органом; если орган меньше, то меньше и кейлонов и больше клеточных делений в этом органе. Если такой механизм и существует, то действует он не везде. Например, потеря одной ноги не приводит сама по себе к увеличению размеров другой ноги.
Деления стволовых и дифференцирующихся клеток крови стимулируются, как мы уже говорили, гормонами, такими, как, например, эритропоэтин. Гормоны стимулируют клеточные деления и во многих других случаях. Например, стимуляция роста числа клеток яйцевода у кур активируется женским половым гормоном. Существуют химические факторы – обычно это небольшие белки, которые действуют не как гормоны, т. е. не разносятся с кровью по всему организму, а влияют более ограниченно, на соседние ткани. Это известные сейчас факторы роста – эпидермальный и др. Однако в большинстве случаев конкретные химические факторы регуляции клеточных делений и механизмы их действия нам неизвестны.
Еще меньше мы знаем о регуляции клеточных делений во время основных процессов морфогенеза – в эмбриональном развитии. Мы уже говорили, что здесь способность одних клеток делиться быстрее, чем другие, является проявлением их дифференцировки. В то же время нельзя не заметить, что дифференцировка и клеточные деления в определенном смысле противостоят друг другу и иногда даже исключают друг друга. В некоторых случаях это связано с невозможностью деления при далеко зашедшей, терминальной дифференцировке клеток. Может ли, например, разделиться эритроцит с его очень специализированной структурой, жесткой оболочкой и почти полной утратой большинства клеточных функций, а у млекопитающих еще и с потерей ядра? Нервные клетки хотя и сохраняют очень высокий темп метаболизма, но их длинный аксон и дендриты, связанные с другими клетками, служат очевидными препятствиями к делению. Если бы такое деление у нервной клетки все же произошло, это привело бы к потере связи этой клетки с другими и, следовательно, к потере ее функции.
Поэтому обычной последовательностью событий является сначала период пролиферации клеток, а уже затем дифференцировка, носящая терминальный характер. Более того, ряд ученых предполагают, что как раз во время клеточных делений хромосомы как бы «освобождаются» для следующего этапа дифференцировки, – последнему митозу перед дифференцировкой придается особое значение. Эти представления носят пока во многом умозрительный характер п не имеют на молекулярном уровне хороших экспериментальных оснований.
Ho и не зная конкретных механизмов регуляции клеточных делений, мы вправе рассматривать их программированный характер как такое же проявление программы развития, каким являются и все остальные его процессы.
В заключение мы кратко остановимся и на явлении, как бы обратном размножению клеток, – их гибели, которая в определенных случаях формообразования является необходимым этапом развития. Так, например, при образовании пальцев в зачатках кисти передних и задних конечностей клетки мезенхимы собираются в плотные тяжи, из которых потом формируются хрящи фаланг. Среди клеток, оставшихся между ними, происходит массовая гибель, за счет которой отчасти пальцы отделяются друг от друга. Нечто похожее происходит и при дифференцировке зачатка крыла у птиц. Механизмы гибели клеток в этих случаях – факторы, внешние по отношению к клеткам, и события внутри клеток – остаются малоизвестными. А. С. Уманский предполагает, например, что гибель клетки начинается с деградации ее ДНК.
Размножение клеток, несмотря на всю его важность, нельзя считать основным механизмом морфогенеза: в создании формы оно участвует все же косвенно, хотя такие важные параметры, как общая форма органа и его относительные размеры, могут регулироваться именно на уровне клеточных делений. Еще меньшую роль играет в морфогенезе программированная гибель клеток. Ho тем не менее они являются в нормальном развитии совершенно необходимыми компонентами. В регуляции этих явлений участвуют практически все компоненты клетки и ее генетический аппарат. Это показывает нам, что в развитии не бывает простых процессов. Попытка до конца разобраться в любом из них заставляет нас обращаться к основным молекулярным механизмам работы клетки. А здесь еще много нерешенного.
Для того чтобы оценить всю сложность развития многоклеточного организма, надо представить себе этот процесс происходящим как бы в многомерном пространстве. Одну ось составляет длинная цепь этапов реализации генетической информации – от гена до признака. Второй такой осью можно назвать всю совокупность генов в хромосомах. В ходе развития продукты различных генов взаимодействуют друг с другом. Развертывание событий но двум осям образует как бы сеть на плоскости. Однако существует п третья ось – разнообразие событий, происходящих в разных частях зародыша. События эти могут происходить относительно автономно, как у животных с мозаичным развитием. Ho частично и у них, а в полной мере у видов с регуляционным типом развития между частями организма осуществляются большие или меньшие взаимодействия и всегда сложные перемещения клеток. Рассматривать их все как одну ось можно, только идя на значительные упрощения. И наконец, все развитие (гаметогенез, эмбриогенез и постэмбриональное развитие) происходит во времени, масштаб которого совершенно иной, чем время, измеряемое на пути от гена до белка. По этой (условно четвертой) оси вся многомерная картина радикально изменяется – яйцо превращается в размножающийся организм. Эта многомерность иллюстрирует сложность всех процессов и их взаимоотношений и трудности их понимания.
У части вирусов роль наследственного вещества выполняет не ДНК, а сходная с ней по строению РНК.
Против моей болезни — псориаза, но все так же по несколько раз в году появляются красные пятна. Потом они проходят, после двух-трех недель. Через какое-то время все повторяется снова. Расскажите подробнее об этой болезни и о том, как от нее избавиться", — просит читательница MedPulse. Что ответит врач-дерматолог?
Врач-дерматолог, к. м.н., Алексей Левин
С чего начинается псориаз?
Псориаз — хроническое, незаразное заболевание кожи, известное еще в допетровской Руси, где этот дерматоз именовали "розами дьявола". Но не столько из-за высокой опасности для жизни (даже зуд здесь появляется не у всех пациентов, а серьезные осложнения — менее чем в 10% случае), сколько из-за необычайно коварного и упорного характера этого недуга. Кожные "розы" могут вдруг исчезнуть, затем дремать годами и вдруг распуститься вновь. И до сих пор псориаз остается одним из самых загадочных недугов.
Например, уже давно предположили, что это — аутоиммунное заболевание. Но недавно американские ученые открыли два гена, ответственные за деление эпидермальных клеток. Мутации в этих генах, по мнению исследователей, и нарушают порядок клеточного деления, приводя к образованию бляшек. Вот вам еще одна возможная причина — генетическая. Но разве не может быть и другая — инфекционно-вирусная? Шведские ученые выделели ретровирус, которые они считают специфическим возбудителем псориаза. Словом, первопричина болезни пока неизвестна.
В группе наибольшего риска — мнительные, тревожные люди с повышенной эмоциональностью, которые и до начала псориаза в ответ на стресс "срывались" на какие -то заболевания. Поэтому, если говорить о профилактике недуга, то посоветовал бы таким людям проще относится к жизненным проблемам.
В северных странах этот дерматоз встречается в два раза чаще, чем в южных. Такую зависимость связывают с количеством солнечного света. Поэтому еще один совет, как уберечься от псориаза — не переусердствовать в защите от солнечных лучей. Существуют гигиенические правила здорового и безопасного естественного загара. Следуйте им, но и не прячьтесь от солнца как Снегурочка!
Стена высокая, но хилая
При псориазе клетки верхнего эпидермального слоя кожи делятся в 30 быстрее чем в норме. Но созревать не успевают, из-за чего между ними не устанавливается прочных связей. В итоге кожа при псориазе напоминает наспех построенную кирпичную стену, высокую, да непрочную.
Внешне эта "стенка" выглядит как серебристо-белые бляшки. Если их потереть, они соскабливаются легко, как капли стеариновой свечи. Это называют симптомом стеаринового пятна. При дальнейшем поскабливании выделяются точечные капельки крови (симптом кровяной росы). Он обусловлен тем, что эпидермис был соскоблен до поверхностных сосудов кожи. В более глубоких слоях при псориазе происходит воспаление и расширяются сосуды кожи. Этим обусловлен розовый или красный цвет бляшек.
Обычный (бляшечный) псориаз, которому и посвящена наша статья, встречается в большинстве (85%) случаев. Другие формы, вместе взятые, составляют около 15%. Эти разновидности не похожи на обычный псориаз, и в их лечении есть много особенностей. Но у любых видов этого недуга самое частое осложнение — псориатический артрит. Если его не лечить, больной становится инвалидом. Помните об этом, и не реже, чем раз в год покажитесь артрологу или ортопеду.
Впервые услышав диагноз "псориаз", многие люди испытывают потрясение и чувство обреченности. Что ж, их можно понять… Ведь полностью выкорчевать "розы дьявола" медицина еще не умеет. И такие больные везде становятся объектом встревоженных взглядов, поскольку заболевания очевидно для окружающих из-за явных внешних проявлений.
Моим пациентам я даю специальные советы по адаптации к болезни:
— узнайте о ней как можно больше, больше общайтесь с другими больными псориазом,
— не стесняйтесь рассказывать людям о своем заболевании, всегда начиная с того, что оно незаразно,
— найдите врача, с которым у вас установился хороший психологический контакт, лечитесь только у него, и относитесь критично к обещаниям других докторов, а тем более знахарей, полностью избавить вас от псориаза,
— не таитесь от друзей и семьи, успокойте их, объяснив, что псориаз, если его тщательно лечить, не опасен для жизни,
— если Вы не справляетесь с переживаниями по поводу недуга, обратитесь к психотерапевту немедленно, ведь на фоне псориаза развиваются особенно быстро, часто в тяжелейших формах.
Как лечат псориаз
Наиболее употребимые против псориаза — препараты наружного применения, и среди них кортикостероиды. Эти гормональные лекарства, уменьшающие воспаление и подавляющие аутоиммунные реакции в коже, выпускаются в форме мазей, кремов, лосьонов. Кортикостероиды начинают действовать быстро, однако со временем утрачивают эффект. Поэтому они хорошо подходят для кратковременного лечения, а при длительном — обязательно сделайте перерыв на несколько недель. Полезны в борьбе с псориазом и кремы, включающие кальципотриол. По химическому строению — это производное витамина D. Препарат уменьшает скорость деления клеток кожи, нормализует их созревание. Древнейшим средством народной медицины для лечения псориаза является деготь (каменноугольный или березовый), который сейчас входит в состав кремов и шампуней.
Против псориаза применяют также искусственное ультрафиолетовое облучение. В зависимости от длины волны оно делится на УФ-А и УФ-В.
Источники УФ-В-излучения есть только в специализированных центрах для лечения псориаза. Это весьма эффективный, но, увы, дорогой метод.
Не входит в стандарты государственной страховой медицины и ПУВА-терапия, то есть УФ-А в сочетании с приемом фотосенсибилизирующих (увеличивающих чувствительность к солнцу) веществ. Но источники УФ-А более распространены и доступны. Именно УФ-А вызывает загар. Поэтому лампы соляриев и бытовых ультрафиолетовых ламп излучают УФ-А. Однако при псориазе это светолечение становится действенным только при комбинации его с фотосенсибилиризующими лекарствами.
Не забывайте и о возможных побочных эффектах светолечения. Это преждевременное старение кожи и увеличение риска рака кожи.
Из лекарства для приема внутрь и инъекций сильным действитем обладают метотрексат — цитостатический препарат, подавляющий ускоренное деление клеток кожи при псориазе; ацитретин, относящийся к производным витамина А и нормализующий деление клеток кожи; наконец, циклоспорин. Это мощнейший иммунодепрессант, который в частности применяют при пересадке органов для предотвращения их отторжения.
Но у этих препаратов есть целый ряд побочных эффектов, о которых вас должен предупредить врач, причем часть их можно ослабить, однако другие неизбежны.
Нужны разгрузочные дни
Чтобы уменьшить риск обострений псориаза, надо помнить о нескольких правилах.
Принимая душ или ванну, используйте не жесткую губку или мочалку, как и твердое мыло, а только мягкую губку или хлопчатобумажную салфетку. После душа примените смягчающий крем, чтобы кожа была гладкой. Носите легкую, просторную, хлопчатобумажную одежду.
Летом ограничьте время, проводимое в условиях кондиционирования. Если же вы вынуждены находиться в таком помещении, то поставьте около себя емкость с водой.
Защищайте кожу от порезов и повреждений, поскольку они могут стать причиной обострения заболевании, сведите до минимума стрессовые ситуации.
Ваше питание должно быть богатым животными белками, витаминами и исключать слишком жирное, острое, и соленое. Во время обострений нельзя принимать антибиотики, спиртные напитки, а также продукты, способные вызвать аллергию (яйца, копчености, цитрусовые, мед, специи).
Отдайте предпочтение вегетарианским супам, а вот вторые блюда пусть будут мясными (лучше отварная или тушеная крольчатина, курятина, индейка). Также полезны молочные продукты, причем обычной (2,5-3,0%) жирности. Дополните основное меню гречневой, перловой и рисовой кашами. На гарнир лучше всего картофель, фасоль, капуста, но не мучнистые продукты. Сырые овощи и фрукты должны присутствовать на столе ежедневно в течение всего года: яблоки, огурцы, помидоры, морковь, свекла, лук, чеснок свежий, укроп, петрушка.
Очень полезны при псориазе 2 разгрузочных дня в неделю. Меню в такие дни можно разнообразить.
Мясной день: 400 г отварной говядины делят на 5 приемов. Дополнительно 2 раза в день по 100 г гарнира (сырая белокочанная капуста, морковь, огурцы) и 2 стакана отвара шиповника.
Творожно-кефирный день: 400 г творога и 500 г кефира принимаются в течение дня в 5 приемов.
Яблочный день: 1,5 кг яблок, лучше кислых сортов (антоновских) в течение дня. Ничего пить в этот день нельзя.
Кефирный день: 1,5 л кефира в течение дня.
Овощной день: 1,5 кг овощей (за исключением картофеля) лучше в тушеном виде. Дополнительно — 2 стакана отвара шиповника или некрепкого несладкого чая. Овощи делятся на 5 приемов.
Если у вас есть опыт лечения народными способами, пожалуйста, пишите в комментариях ниже.
20 Января 2014XXI столетие ознаменовалось наступлением новой эры в области диетологии, продемонстрировавшей огромную пользу, которую может принести здоровью человека правильный подбор рациона. С этой точки зрения поиски секрета «таблеток от старости» уже не выглядят несбыточной мечтой. Последние открытия ученых указывают на то, что определенным образом подобранное питание может, по крайней мере частично, изменить ход биологических часов организма и замедлить его старение. В данной статье современная информация, полученная специализирующимися в области диетологии учеными, проанализирована в контексте улучшения состояния теломер, являющегося ключевым механизмом замедления старения в буквальном смысле этого слова.
Теломеры – это повторяющиеся последовательности ДНК, локализующиеся на концах хромосом. При каждом делении клетки теломеры укорачиваются, что в конечном итоге приводит к утрате клеткой способности к делению. В результате клетка вступает в фазу физиологического старения, ведущую к ее гибели. Накопление таких клеток в организме повышает риск развития заболеваний. В 1962 году Леонард Хейфлик (Leonard Hayflick) совершил революцию в биологии, разработав теорию известную как теория предела Хейфлика. Согласно этой теории, максимальная потенциальная продолжительность жизни человека составляет 120 лет. Согласно теоретическим подсчетам, именно к этому возрасту в организме становится слишком много клеток, не способных делиться и поддерживать его жизнедеятельность. Пятьдесят лет спустя появилось новое направление науки о генах, открывшее человеку перспективы оптимизации его генетического потенциала.
Различные стрессовые факторы способствуют преждевременному укорочению теломер, что, в свою очередь, ускоряет биологическое старение клеток. Многие пагубные для здоровья возрастные изменения организма ассоциированы с укорочением теломер. Доказано существование взаимосвязи между укорочением теломер и заболеваниями сердца, ожирением, сахарным диабетом и дегенерацией хрящевой ткани. Укорочение теломер снижает эффективность функционирования генов, что влечет за собой триаду проблем: воспаление, окислительный стресс и снижение активности иммунных клеток. Все это ускоряет процесс старения и повышает риск развития возрастных болезней.
Еще одним важным аспектом является качество теломер. Например, пациенты с болезнью Альцгеймера далеко не всегда имеют короткие теломеры. В то же время их теломеры всегда демонстрируют выраженные признаки функциональных нарушений, коррекции которых способствует витамин Е. В определенном смысле теломеры являются «слабым звеном» ДНК. Они легко повреждаются и нуждаются в восстановлении, однако не располагают мощными репарационными механизмами, используемыми другими регионами ДНК. Это приводит к накоплению частично поврежденных и плохо функционирующих теломер, низкое качество которых не зависит от их длины.
Одним из подходов к замедлению процесса старения является применение стратегий, замедляющих процесс укорочения теломер, одновременно защищающих их и устраняющих возникающие повреждения. В последнее время специалисты получают все больше данных, согласно которым этого можно добиться путем правильного подбора рациона питания.
Еще одной привлекательной перспективой является возможность удлинения теломер с одновременным поддержанием их качества, что в прямом смысле позволит повернуть стрелки биологических часов вспять. Этого можно добиться путем активизации фермента теломеразы, способного восстанавливать утраченные фрагменты теломер.
Базовое питание для теломер
Активность генов проявляет определенную гибкость, и питание является превосходным механизмом компенсирования генетических недостатков. Многие генетические системы закладываются в течение первых недель внутриутробного развития и формируются в раннем возрасте. После этого они подвергаются влиянию широкого спектра факторов, в т.ч. пищевых. Это влияние можно назвать «эпигенетическими настройками», определяющими то, как гены проявляют заложенные в них функции.
Длина теломер также регулируется эпигенетически. Это означает, что на нее оказывает влияние рацион питания. Плохо питающиеся матери передают детям неполноценные теломеры, что в будущем повышает риск развития заболеваний сердца (для клеток пораженных атеросклерозом артерий характерно большое количество коротких теломер). Напротив, полноценное питание матери способствует формированию у детей теломер оптимальной длины и качества.
Для полноценного функционирования теломер необходимо их адекватное метилирование. (Метилирование – это химический процесс, заключающийся в присоединении к нуклеиновому основанию ДНК метильной группы (-CH3).) Основным донором метильных групп в клетках человека является кофермент S-аденозилметионин, для синтеза которого организм использует метионин, метилсульфонилметан, холин и бетаин. Для нормального протекания процесса синтеза этого кофермента необходимо присутствие витамина В12, фолиевой кислоты и витамина В6. Фолиевая кислота и витамин В12 одновременно вовлечены во многие механизмы, обеспечивающие стабильность теломер.
Наиболее важными пищевыми добавками для поддержания теломер являются качественные витаминные комплексы, принимаемые на фоне рациона, содержащего адекватное количество белков, в особенности серосодержащих. В такой рацион должны входить молочные продукты, яйца, мясо, курица, бобовые, орехи и зерновые. Яйца являются наиболее богатым источником холина.
Для поддержания хорошего настроения мозгу также требуется большое количество метильных доноров. Хронический стресс и депрессия часто свидетельствуют о дефиците метильных доноров, что означает плохое состояние теломер и их подверженность преждевременному укорочению. Это является основной причиной того, что стресс старит человека.
Результаты исследования с участием 586 женщин показали, что теломеры участниц, регулярно принимавших мультивитамины, были на 5% длиннее теломер женщин, не принимавших витамины. У мужчин наиболее высокие уровни фолиевой кислоты соответствовали более длинным теломерам. Еще одно исследование с участием людей обоих полов также выявило положительную взаимосвязь между содержанием фолиевой кислоты в организме и длиной теломер.
Чем большую нагрузку вы испытываете и/или чем хуже себя чувствуете эмоционально или психически, тем больше внимания вам следует уделять получению достаточного количества базовых питательных веществ, которые помогут не только вашему мозгу, но и вашим теломерам.
Минералы и антиоксиданты способствуют сохранению стабильности генома и теломер
Питание является превосходным механизмом замедления износа организма. Многие питательные вещества защищают хромосомы, в том числе теломеразную ДНК, и повышают эффективность работы механизмов восстановления ее повреждений. Недостаток антиоксидантов ведет к увеличению количества повреждений под действием свободных радикалов и повышению риска деградации теломер. Например, теломеры пациентов с болезнью Паркинсона короче, чем теломеры здоровых людей такого же возраста. При этом степень деградации теломер непосредственно зависит от выраженности свободно-радикальных повреждений, ассоциированных с заболеванием. Также показано, что женщины, употребляющие с пищей мало антиоксидантов, имеют короткие теломеры и входят в группу повышенного риска развития рака молочной железы.
Для функционирования многих ферментов, вовлеченных в копирование и восстановление повреждений ДНК, необходим магний. Одно из исследований на животных показало, что недостаток магния ассоциирован с увеличением выраженности свободно-радикальных повреждений и укорочением теломер. Эксперименты на клетках человека продемонстрировали, что отсутствие магния приводит к стремительной деградации теломер и подавляет деление клеток. В день, в зависимости от интенсивности нагрузки и уровня стресса, организм человека должен получать 400-800 мг магния.
Цинк играет важную роль в функционировании и восстановлении ДНК. Недостаток цинка приводит к появлению большого количества разрывов цепочек ДНК. У пожилых людей недостаток цинка ассоциирован с короткими теломерами. Минимальное количество цинка, которое человек должен получать в день, составляет 15 мг, а оптимальные дозировки составляют около 50 мг в день для женщин и 75 мг – для мужчин. Получены данные, согласно которым новый цинкосодержащий антиоксидант карнозин уменьшает скорость укорочения теломер в фибробластах кожи, одновременно замедляя их старение. Карнозин также является важным антиоксидантом для мозга, что делает его хорошим помощников в борьбе со стрессом. Многие антиоксиданты способствуют защите и восстановлению ДНК. Например, установлено, что витамин С замедляет укорочение теломер в клетках сосудистого эндотелия человека.
Впечатляет тот факт, что одна из форм витамина Е, известная как токотриенол, способна восстанавливать длину коротких теломер в фибробластах человека. Также есть данные о способности витамина С стимулировать активность удлиняющего теломеры фермента теломеразы. Эти данные свидетельствуют в пользу того, что употребление определенных продуктов питания способствует восстановлению длины теломер, что потенциально является ключом к обращению процесса старения вспять.
ДНК находится под непрерывной атакой свободных радикалов. У здоровых полноценно питающихся людей система антиоксидантной защиты частично предотвращает и восстанавливает повреждения ДНК, что способствует сохранению ее функций.
По мере старения человека его здоровье постепенно ухудшается, в клетках происходит накопление поврежденных молекул, запускающих процессы свободно-радикального окисления и препятствующих восстановлению повреждений ДНК, в том числе теломер. Этот процесс, нарастающий по принципу «снежного кома», может усугубляться такими состояниями, как ожирение.
Воспаление и инфекции способствуют деградации теломер
На современном уровне понимания биологии теломер наиболее реалистичной перспективой является разработка методов замедления процесса их укорочения. Возможно, со временем человеку удастся достичь своего предела Хейфлика. Это возможно только в том случае, если мы научимся препятствовать износу организма. Сильные стрессы и инфекции являются двумя примерами причин такого износа, ведущего к укорочению теломер. Оба воздействия имеют выраженный воспалительный компонент, стимулирующий продукцию свободных радикалов и вызывающий повреждения клеток, в том числе теломер.
В условиях сильного воспалительного стресса гибель клеток стимулирует их активное деление, что, в свою очередь, ускоряет деградацию теломер. Кроме того, формирующиеся при воспалительных реакциях свободные радикалы также повреждают теломеры. Таким образом, мы должны прикладывать максимальные усилия к подавлению как острых, так и хронических воспалительных процессов и предотвращению инфекционных заболеваний.
Однако полное исключение из жизни стрессов и воспалительных реакций является невыполнимой задачей. Поэтому хорошей идеей при травмах и инфекционных заболеваниях является добавление в рацион витамина D и докозагексаеновой кислоты (омега-3 жирной кислоты), способных оказать поддержку теломерам в условиях воспаления.
Витамин D модулирует количество тепла, генерируемого иммунной системой в ответ на воспаление. При дефиците витамина D существует опасность перегрева организма, синтеза огромного количества свободных радикалов и повреждения теломер. Способность переносить стресс, в том числе инфекционные заболевания, во многом зависит от уровня витамина D в организме. В исследовании с участием 2 100 близнецов женского пола в возрасте 19-79 лет ученые продемонстрировали, что наиболее высокие уровни витамина D ассоциированы с наиболее длинными теломерами, и наоборот. Разница в длине теломер при наиболее высоких и наиболее низких уровнях витамина D соответствовала примерно 5 годам жизни. Еще одно исследование показало, что употребление взрослыми с избыточной массой тела 2 000 МЕ витамина D в день стимулирует активность теломеразы и способствует восстановлению длины теломер, несмотря на метаболический стресс.
Подавление воспалительных процессов естественным образом путем коррекции рациона питания является ключом к сохранению теломер. Немаловажную роль в этом могут сыграть омега-3 жирные кислоты – докозагексаеновая и эйкозапентаеновая. Наблюдение за группой пациентов с заболеваниями сердечно-сосудистой системы в течение 5 лет показало, что наиболее длинные теломеры были у пациентов, употреблявших большее количество этих жирных кислот, и наоборот. При проведении еще одного исследования было установлено, что повышение уровня докозагексаеновой кислоты в организме пациентов с умеренными нарушениями познавательной функции снижало скорость укорочения их теломер.
Существует очень большое количество пищевых добавок, подавляющих активность воспалительного сигнального механизма, опосредуемого ядерным фактором каппа-би (NF-kappaB). Экспериментально доказано положительное влияние на состояние хромосом, оказываемое посредством запуска этого противовоспалительного механизма, таких природных соединений, как кверцетин, катехины зеленого чая, экстракт виноградных косточек, куркумин и ресвератрол. Обладающие этим свойством соединения также содержатся во фруктах, овощах, орехах и цельном зерне.
Одним из наиболее активно изучаемых природных антиоксидантов является куркумин, придающий ярко-желтую окраску приправе карри. Разные группы исследователей изучают его способность стимулировать восстановление повреждений ДНК, в особенности эпигенетических нарушений, а также предотвращать развитие рака и повышать эффективность его лечения.
Еще одним многообещающим природным соединением является ресвератрол. Результаты исследований на животных свидетельствуют о том, что ограничение калорийности рациона при сохранении его питательной ценности сохраняет теломеры и увеличивает продолжительность жизни за счет активации гена sirtuin 1 (sirt1) и повышению синтеза белка сиртуина-1. Функция этого белка заключается в «настройке» систем организма на работу в «режиме экономии», что очень важно для выживания вида в условиях недостатка питательных веществ. Ресвератрол напрямую активирует ген sirt1, что положительно сказывается на состоянии теломер, в особенности в отсутствие переедания.
На сегодняшний день очевидно, что короткие теломеры являются отражением низкого уровня способности систем клетки к восстановлению повреждений ДНК, в том числе теломер, что соответствует повышенному риску развития рака и болезней сердечно-сосудистой системы. В рамках интересного исследования с участием 662 человек у участников с детского возраста до 38 лет регулярно оценивали содержание в крови липопротеинов высокой плотности (ЛПВП), известных как «хороший холестерин». Наиболее высокие уровни ЛПВП соответствовали наиболее длинным теломерам. Исследователи считают, что причина этого кроется в менее выраженном накоплении воспалительных и свободно-радикальных повреждений.
Резюме
Основной вывод из всего вышеперечисленного заключается в том, что человек должен вести образ жизни и соблюдать рацион питания, минимизирующие износ организма и предотвращающие повреждения, вызываемые свободными радикалами. Важным компонентом стратегии защиты теломер является употребление продуктов, подавляющих воспалительные процессы. Чем лучше состояние здоровья человека, тем меньше усилий он может предпринимать, и наоборот. Если вы здоровы, ваши теломеры будут укорачиваться в результате нормального процесса старения, поэтому для минимизации этого влияния вам достаточно по мере взросления (старения) увеличивать поддержку теломер с помощью пищевых добавок. Параллельно этому следует вести сбалансированный образ жизни и избегать видов деятельности и употребления веществ, оказывающих отрицательное влияние на здоровье и ускоряющих деградацию теломер.
Более того, при неблагоприятных стечениях обстоятельств, таких как несчастные случаи, заболевания или эмоциональные травмы, теломерам следует обеспечивать дополнительную поддержку. Затяжные состояния, такие как посттравматический стресс, чреваты укорочением теломер, поэтому очень важным условием для любого типа травмы или неблагоприятного воздействия является полное восстановление.
Теломеры отражают жизнеспособность организма, обеспечивающую его способность справляться с различными задачами и требованиями. При укорочении теломер и/или их функциональных нарушениях организму приходится прилагать бОльшие усилия для того, чтобы выполнять повседневные задачи. Такая ситуация приводит к накоплению в организме поврежденных молекул, что затрудняет процессы восстановления и ускоряет старение. Это является предпосылкой развития целого ряда заболеваний, указывающих на «слабые места» организма.
Состояние кожи является еще одним показателем статуса теломер, отражающим биологический возраст человека. В детстве клетки кожи делятся очень быстро, а с возрастом скорость их деления замедляется в стремлении сэкономить утрачивающие способность к восстановлению теломеры. Лучше всего биологический возраст оценивать по состоянию кожи предплечий рук.
Сохранение теломер является исключительно важным принципом сохранения здоровья и долголетия. Сейчас перед нами открывается новая эра, в которой наука демонстрирует все новые способы замедления старения с помощью продуктов питания. Никогда не поздно и не рано начать вносить в свой образ жизни и рацион питания изменения, которые направят вас в нужном направлении.
Евгения Рябцева
Портал «Вечная молодость» по материалам NewsWithViews.com:
Мгновенное заживление ран и молниеносное развитие эмбрионов – эти картины из фантастических фильмов могут стать реальностью.
Многочисленные исследования, которые сейчас ведут учёные, уже показали, что ключевую роль при эмбриональном развитии и регенерации тканей играют биоэлектрические сигналы, генерирующиеся с участием клеточной мембраны. Например, на модели заживления раны роговицы было показано, что колебания мембранного потенциала, создающие в ткани электрические поля, регулируют миграцию клеток, их поляризацию и частоту делений, то есть восстановление поврежденной ткани. Потенциал клеточной мембраны формируется при участии имеющихся в ней ионных каналов. Ионные токи, как показывают исследования, имеют огромное значение для деления (дифференцировки) клеток - миобластов, кардиомиоцитов, нейронов. При их делении и слиянии потенциал мембраны изменяется от -10 до -70 мВ, т.е. мембрана становится более отрицательно заряженной (гиперполяризуется). Однако что тут следствие, а что причина: то ли электросигналы – следствие клеточных изменений, то ли наоборот, до сих пор было неясно.
Группа исследователей из Университета Тафтса в Медфорде (Tufts University, Medford, Массачусетс, США) изучили влияние изменения мембранного потенциала на способность клеток ММСК (мультипотентных мезенхимальных стромальных клеток) костного мозга человека к делению. Сначала они исследовали, зависит ли изменение мембранного потенциала клеток от стадии их деления. Чтобы запустить деление клеток, авторы исследования воздействовали на них химически, с помощью двух веществ (дексаметазона и индометацина), и затем отслеживали изменение яркости окраски флуоресцентного красителя, реагирующего на величину мембранного потенциала (деполяризацию клетки). Выяснилось, что флуоресценция по мере дифференцировки клетки уменьшается, т.е. потенциал снижается и происходит гиперполяризация клеточной мембраны. Происходит это постепенно – в течение второй, третьей недели, и достигает максимума к четвертой неделе дифференцировки клеток.
Далее исследователи проверили, как будет влиять на деление клеток искусственное уменьшение гиперполяризации мембраны клетки. Деполяризацию клеточной мембраны они вызвали, повысив концентрацию ионов калия в среде культивирования клеток. Результат такого воздействия оценивали по появлению маркеров – характерных генов, возникающих при дифференцировке исследуемых клеток. Также клеточные колонии окрашивали специфичным для определенного вида клеток красителем. Оказалось, что деполяризация клеточной мембраны подавляет деление клеток, причем обратимо. При возвращении в стандартные условия стволовые клетки костного мозга восстанавливали свою способность к делению спустя три недели. Мембранный потенциал при этом возвращался к исходному уровню.
Тогда исследователи решили провести обратный эксперимент – увеличить гиперполяризацию клеточной мембраны. Для этого клетки подвергли воздействию соответствующих веществ (пинацидила и диазоксида). Через семь суток оценка эффективности дифференцировки клеток показала, что экспрессия генов-маркеров повышается в 2-4 раза! Причем с повышением концентрации веществ-поляризаторов увеличивалась и экспрессия маркерных генов.
Таким образом группе из Университета Тафтса в Медфорде удалось доказать, что изменение мембранного потенциала в сторону гиперполяризации предшествует дифференцировке клеток, и что с его помощью можно увеличивать эффективность дифференцировки ММСК под действием соответствующих веществ.
Сейчас исследователи занимаются изучением механизма влияния мембранного потенциала на дифференцировку клеток. Они уверены, что в будущем контроль потенциала мембраны будет широко использоваться для стимулирования дифференцировки различных типов стволовых клеток в нужном направлении.

В основе омолаживающих процедур, которые проводит косметолог для улучшения внешнего вида лица и устранения морщин, лежит регенерация клеток кожи, которую необходимо стимулировать. Для этого имеются множество косметических средств и процедур, действие которых направлено на активизацию клеточных процессов в таких слоях кожи, как эпидермис и дерма, а также на ускорение выработки коллагена и эластина. Методики и средства омоложения подбираются с учетом способности кожи отвечать на стимулирующее воздействие.
Некоторые причины замедленной регенерации клеток кожи
Медленное обновление клеток в стареющей коже происходит из-за снижения скорости их деления в базальном слое, а также из-за нарушения процесса слущивания чешуек рогового слоя. В результате нарушается барьерная функция кожи, увеличивается количество дефектных клеток в эпидермисе, ухудшается общий внешний вид кожи.
Дерма страдает от внешних повреждающих факторов среды не намного меньше эпидермиса, а потому тоже нуждается в обновлении. Фибробласты этого слоя кожи постоянно синтезируют волокна эластина и коллагена, гиалуроновую кислоту, другие гликозамингликаны и так же постоянно их разрушают, поддерживая процессы регенерации кожи. Со временем фибробласты утрачивают возможность синтезировать межклеточное вещество так же быстро, как раньше, и скорость обновления дермы замедляется.
Возможные пути стимулирования регенерации клеток кожи
Сегодня перспективными стали исследования возможностей стволовых клеток, способных к почти бесконечному делению. Принято считать, что стволовые клетки эпидермиса расположены в области bulge волосяного фолликула, что подтверждается некоторыми экспериментами, в процессе которых ученым удавалось вырастить фрагмент полноценной кожи из клеток волосяного фолликула.
Кроме того, к интенсивному делению способны клетки базального слоя кожи, причем именно те из них, которые располагаются на углубленных в дерму участках эпидермиса. Скорость обновления эпидермиса зависит от темпа деления клеток базального слоя, но не напрямую, поскольку они делятся гораздо быстрее необходимого. Эта особенность базального слоя объясняется необходимостью создания некоторых резервов на случай повреждения кожи и потребности в немедленной регенерации клеток кожи. В обычных условиях эпидермис сдерживает этот процесс за счет выработки кейлонов, ингибирующих клеточное деление, и поддерживает оптимальную толщину рогового слоя.
При любом повреждающем воздействии на кожу скорость деления базальных клеток увеличивается. Если повреждение происходит на небольшом участке, утолщение кожи происходит локально (яркий пример тому - образование мозоли на стертом участке стопы). Повреждение кожи на большой площади вызывает акантоз - общее утолщение эпидермиса (например, после избыточной инсоляции кожа на теле становится более грубой и плотной).
Методы и средства стимулирования регенерации клеток кожи
В косметологии один из способов стимулировать кожу к регенерации - пилинг - основан именно на этом свойстве кожи отвечать на ее повреждение активным делением клеток базального слоя. Другой способ дать им сигнал к интенсивному размножению - использовать цитокины и ретиноиды.
Цитокины - это медиаторы белковой природы, которые участвуют в межклеточной передаче сигналов, регулируют пролиферацию и дифференцировку клеток. Ретиноиды способны напрямую стимулировать клетки эпидермиса к делению и дифференцировке, а также ослаблять связи между клетками рогового слоя, что способствует их отшелушиванию.
Фитоээстрогены - еще одно средство, стимулирующее регенерацию клеток кожи. Фитоэстрогены могут ускорить клеточное обновление, если клетки стали медленнее делиться из-за недостаточной гормональной стимуляции.
Стимуляция клеток эпидермиса к обновлению способствует активизации фибробластов дермы, что ведет к усилению синтеза коллагена и эластина. В качестве таких стимуляторов в составе косметических средств, ускоряющих регенерацию клеток кожи и способствующих разглаживанию некоторых видов морщин, могут выступать следующие вещества:
- N-ацетил-L-цистеин (серосодержащая аминокислота);
- гамма-аминобутировая кислота;
- неомыляемые фракции масла авокадо, соевого масла;
- полисахариды стенки дрожжей;
- очищенные полисахариды геля алоэ;
- L-аскорбиновая кислота.
Выбор средства и метода для регенерации клеток кожи и ее общего омоложения, а также для ее лечения в случае повреждения или УФ-облучения зависит от выраженности признаков старения или характера повреждения, а также от способности кожи отвечать на стимулирующие действия. Если же деградация клеток в силу возраста или влияния внешних факторов зашла слишком далеко и кожа не отвечает на косметическое воздействие, понадобятся более интенсивные омолаживающие процедуры или помощь пластической хирургии.