А.В. Мурашко
Клиника акушерства и гинекологии ММА им. И.М. Сеченова
Клинические исследования, проведённые в последние годы, выявили факт недостаточного использования антикоагулянтной терапии для профилактики и лечения тромбоэмболических заболеваний и потенциальные возможности этой терапии. Более полувека назад был открыт и стал использоваться гепарин. Открытие и внедрение низкомолекулярных гепаринов расширило клинические возможности профилактической и лечебной помощи, наряду с повышением безопасности терапии. Мультидисциплинарные исследования показали многогранность действия гепарина и НМГ. Среди потенциальных механизмов их действия – антикоагулянтное, антитромботическое, противовоспалительное, противоопухолевое. Этим объясняются широкие показания для использования антикоагулянтной терапии – профилактика венозных тромбозов, в т. ч. тромбоэмболии лёгочной артерии, профилактика артериальных тромбозов при заболеваниях клапанов сердца, хронической сердечной недостаточности, нарушениях ритма сердца.
Беременность и первый месяц после родов относятся к периоду повышенного риска тромбоэмболических заболеваний. Создаются благоприятные условия для тромбообразования, включающие все элементы: стаз крови, гиперкоагуляция, повреждение сосудов. Гормональные изменения, приводящие к расслаблению гладкой мускулатуры стенок сосудов, застой крови, увеличение концентрации факторов коагуляции и снижение фибринолитической активности ведут к повышенному риску тромбоэмболических осложнений.
По мере прогрессирования беременности в крови матери увеличивается коагуляционный потенциал за счёт прироста количества фибриногена. Кроме того, постепенно увеличивается активность факторов (VIII, IX, X, XI и XII), составляющих внутренний путь свёртывания крови, а также факторов внешнего пути (II, V, VII, X), вызывающих повышение протромбинового индекса. В целом, в конце беременности постепенно возникает состояние повышенной свёртываемости крови.
Состояние гиперкоагуляции компенсируется многими факторами, в т. ч. протеином С, S, антитромбином III. Однако этот баланс является нестойким. Например, физиологический процесс послеродового отторжения плаценты сопровождается большим выбросом тромбопластина и резким выключением плацентарных факторов противосвёртывающей системы, что приводит к активации всех компонентов. Повреждение эндотелия сосудов (при преждевременной отслойке плаценты, гестозе, воспалительных изменениях при тромбофлебите и флеботромбозе и др. состояниях) также может привести к аналогичным последствиям с последующей активацией системы гемостаза. Таким образом, беременность связана с увеличением концентраций в плазме факторов коагуляции и ингибиторов фибринолиза, изменениями характера венозного тока крови и изменениями сосудистой стенки.
Развитие наиболее грозного тромбоэмболического осложнения (ТЭО) – тромбоэмболии лёгочной артерии во время беременности встречается с частотой 0,3-1 на 1000 беременных. Фатальная тромбоэмболия лёгочной артерии (ТЭЛА) остаётся ведущей причиной материнской смертности во всём мире. Частота ТЭО среди беременных с заболеваниями вен значительно выше, чем в популяции, достигая 10 %. Материнская смертность среди беременных с протезированными клапанами сердца составляет 1-4 %. К группе повышенного риска относятся беременные с заболеваниями клапанов сердца, выраженной лёгочной гипертензией, с обструкцией выходного тракта левого желудочка, с тяжёлыми цианотическими врождёнными синдромами. У 80 % беременных развиваются нарушения ритма сердца, часть из которых способна привести к ТЭО.
Ниже приводится идентификация пациентов высокого риска ТЭО:
1. Наличие в анамнезе ВТЭО.
Частота ВТЭО и рецидива ВТЭО во время беременности составляет 0,05-1,8 % и 1,4-11,1 % соответственно (Brill-Edwards et al., 2000).
2. Наследственные тромбофилические состояния (табл. 1).
3. Неблагоприятные исходы предыдущих беременностей (тяжёлая преэклампсия, HELLP-синдром, внутриутробная гибель плода, отслойка плаценты.
Скрининг тромбофилических мутаций следует проводить у пациенток с анамнезом ТГВ или ВТЭ, необъяснимой потерей плода до 20 недель беременности, тяжёлой преэкламспией/HELLP синдромом, выраженной ВЗРП или семейным анамнезом тромбозов, ранних инсультов и/или инфарктов.
Базовый тромбофилический скрининг включает исследования: мутацию фактора V Leiden, мутацию гена протромбина, дефицит протеинов С и S (в т. ч., функциональный), дефицит АТ-III, ВА, уровень гомоцистеина, антикардиолипиновые антитела.
4. Предстоящее хирургическое вмешательство.
Низкий риск: пациентки Средний риск: хирургическое вмешательство > 30 мин под общей анестезией и > 40 лет или дополнительные факторы риска, или Высокий риск: > 40 лет или дополнительные факторы риска, «большое» хирургическое вмешательство.
5. Длительное использование антикоагулянтов до беременности.
Если женщина до беременности длительно получала антикоагулянты, то попытка отмены антикоагулянтов во время беременности приводит к повышенному риску тромбоэмболических осложнений.
6. Женщины с искусственными клапанами сердца.
Женщины с искусственными клапанами сердца представляют высочайший риск по развитию ТЭО во время беременности и послеродового периода.
7. Дополнительные факторы риска (табл. 2).
Медикаментозная профилактика ТЭО во время беременности, родоразрешения и послеродового периода
Антикоагулянты во время беременности назначают для предотвращения и лечения ВТЭО, профилактически у женщин с протезированными клапанами, при тромбофилии и ряде других осложнений беременности, хотя назначение антикоагулянтов во время беременности всякий раз представляет проблему, заставляющую взвешивать все «плюсы и минусы» от данного лечения.
На сегодняшний момент доступны для профилактики и лечения ВТЭО следующие антикоагулянты: производные кумарина (варфарин и др.), гепарин и его производные (НФГ, НМГ и гепариноиды), непрямые ингибиторы Ха-фактора (фондапаринукс) и прямые ингибиторы тромбина (гирудин и его производные, олигопептиды).
Терапия матери антикоагулянтами потенциально может сопровождаться двумя видами осложнений со стороны плода – это тератогенное действие и кровотечение. Ни НФГ, ни НМГ не пересекают плаценту, соответственно не имеют потенциальной возможности вызвать кровотечение или оказать тератогенное действие у плода, хотя кровотечение в месте соединения плаценты с маткой возможно. Многие исследования статистически значимо подтверждают безопасность НМГ/НФГ терапии для плода.
Напротив, производные кумарина (варфарин) переходят через плаценту и потенциально могут вызывать кровотечение у плода и оказать тератогенное действие. Производные кумарина могут вызывать как эмбриопатию, включающую назальную гипоплазию и/или уродства костей и хрящей, напоминающие пункционную хондромаляцию эпифизов конечностей, после применения антагонистов витамина К в I триместре беременности, и нарушения ЦНС при использовании на любом сроке беременности. Вероятно, эти препараты безопасны в первые 6 недель беременности, но потенциально тератогенны в случае их приёма с 6 по 12 недели гестации. И хотя в ряде исследований сообщали об успешном использовании кумаринов во II и III триместрах, которое не было связано с врождёнными пороками и нарушениями развития потомства, психоневрологические проблемы у этих детей отмечались чаще. Кроме того, антагонисты витамина К (АВК) вызывают антикоагулянтный эффект у плода, что вызывает тревогу, особенно в момент родоразрешения, когда сочетание антикоагуляционного действия препарата и сдавления в родах может привести к развитию кровотечения и кровоизлияний у новорождённого (табл. 3).
Прямые ингибиторы тромбина перорального введения (в частности, ксимелагатрана) имеют высокую эффективность для профилактики и лечения ВТЭО у небеременных пациентов, аналогичную применению варфарина. Применение прямых ингибиторов тромбина в эксперименте на животных, несмотря на их проникновение через плаценту и переход в материнское молоко, показало отсутствие повреждающего действия на плод. Однако на данный момент имеется крайне мало данных об их безопасности во время беременности.
Основываясь на безопасности, НФГ и НМГ являются антикоагулянтами выбора во время беременности в тех ситуациях, когда их эффективность доказана. Доказано, что НМГ не проникают через плаценту, и результатом многих клинических исследований явилось подтверждение безопасности НМГ для плода. Накопленный опыт по использованию НМГ (в частности, надропарин натрия) для предотвращения и лечения ВТЭО во время беременности свидетельствует, что НМГ также эффективны и безопасны как НФГ.
В отличие от НФГ, НМГ имеют меньшую афинность к связыванию с белками плазмы, эндотелиальными клетками и макрофагами. Эти различия и объясняют фармакокинетические особенности НМГ. НМГ имеют преимущества по сравнению с НФГ – биодоступность НМГ после в/в или п/к введения составляет 87-98 %, в то время как биодоступность гепарина после п/к введения – 15-25 %, период биологической полужизни НМГ в два раза дольше, чем у НФГ, при п/к введении у НМГ более предсказуемый дозазависимый ответ, НМГ реже вызывают гепарининдуцированную тромбоцитопению (ГИТ), возможно одно- или двухкратное введение в сутки, не требуется лабораторный контроль. В связи с вышеуказанными факторами, в последние десятилетия НМГ вытесняют НФГ в профилактике и лечении тромбоэмболических заболеваний (табл. 4).
1.1. Наличие эпизода ВТЭО до беременности
У пациентов с единичным эпизодом ВТЭО, вызванным транзиторным фактором, который в настоящее время отсутствует, рекомендуют клиническое наблюдение и послеродовые антикоагулянты. Если предыдущий эпизод ВТЭО был связан с беременностью или приёмом эстрогенов, или присутствуют дополнительные факторы риска (например ожирение), рекомендуют начать профилактику антикоагулянтами во время беременности.
У пациенток с единичным идиопатическим эпизодом ВТЭО, которые не получали длительно антикоагулянты, рекомендуют профилактические дозы НМГ или минидозы НФГ или средние дозы НФГ, или клиническое наблюдение с последующим назначением антикоагулянтов после родов.
У пациентов с единичным эпизодом ВТЭО и тромбофилией (подтверждённой лабораторно) или семейным анамнезом тромбозов и не получавших длительно антикоагулянты, рекомендуют профилактические или средние дозы НМГ или минидозы, или средние дозы НФГ с назначением антикоагулянтов в послеродовом периоде.
У женщин с дефицитом антитромбина в сочетании с гетерозиготной или гомозиготной мутацией по протромбину или Лейденовского фактора рекомендуют средние дозы НМГ или средние дозы НФГ.
Женщинам с множественными эпизодами (два и более) ВТЭО и/или женщины, получавшие длительно антикоагулянты (например, по поводу предыдущего эпизода ВТЭО), рекомендуют индивидуально подобранную дозу НФГ или индивидуально подобранную дозу НМГ с последующим длительным назначением антикоагулянтов после родов.
1.2. Тромбофилия и ВТЭО, связанные с беременностью
У антитромбин-дефицитных женщин, имеющих гетерозиготную мутацию протромбина или Лейденовскую мутацию, или гомозиготные по указанным состояниям, без предшествующих эпизодов ВТЭО, рекомендуют активную профилактику.
У всех других пациенток с отсутствием предшествующих эпизодов ВТЭО и подтверждённой лабораторно тромбофилии рекомендуют наблюдение или профилактические дозы НМГ, или минидозы НФГ с продолжением антикоагулянтов после родов.
2. Лечение ВТЭО во время беременности
2.1. Женщинам с ВТЭО, развившимся во время беременности, рекомендуют индивидуально подобранные дозы НМГ на протяжении всей беременности или в/в НФГ (болюсно с последующим введением для поддержания АЧТВ в терапевтическом диапазоне) в течение минимум 5 дней, с последующим переходом на НФГ или НМГ на всю оставшуюся беременность. Антикоагулянты следует вводить в течение 3-6 месяцев послеродового периода.
2.2. Перед плановым родоразрешением рекомендуют отменить гепарин за 24 ч до родоразрешения.
3. Тромбофилия и осложнения беременности
3.1. Женщинам с привычной потерей беременности (3 и более), а также с наличием в анамнезе тяжёлых форм гестоза, отслойки плаценты, внтуриутробной гибели плода и замершей беременности рекомендуют скрининг на врождённую тромбофилию и АФА.
3.2. Женщинам с АФА и анамнезом выкидышей (2 и более) или 1 и более потерей беременности на более позднем сроке, гестозом, внутриутробной задержкой развития плода (ВЗРП) или отслойкой плаценты в анамнезе рекомендуют аспирин плюс минидозы или средние дозы НФГ, или профилактические дозы НМГ.
3.3. Для женщин, имеющих мутацию МТГФР, рекомендуют поддерживающие дозы фолиевой кислоты в период зачатия, а если уже беременна, то начать как можно скорее и продолжить её приём на протяжении всей беременности.
3.4. Женщинам с врождёнными тромбофилическими мутациями и повторными выкидышами, потерей беременности в более поздние сроки, тяжёлой формой гестоза в анамнезе, отслойкой плаценты рекомендуют терапию аспирином низкими дозами плюс профилактическое назначение минидоз гепарина или профилактических доз НМГ, с продолжением приёма антикоагулянтов в послеродовом периоде.
3.5. Женщины с АФА и анамнезом венозного тромбоза обычно получают антикоагулянтную терапию в связи с высоким риском рецидива. Во время беременности рекомендуют индивидуально подобранную дозу НМГ или НФГ с малыми дозами аспирина с последующими антикоагулянтами в послеродовом периоде.
3.6. Женщин с АФА и отсутствием анамнеза ВТЭО или потерь беременности следует отнести к группе повышенного риска развития ВТЭО при данной беременности и возможно потери беременности. Им рекомендуют следующее: активное наблюдение, минидозы гепарина или профилактические дозы НМГ, и/или низкие дозы аспирина (75-162 мг/д).
4. Ведение женщин, длительно получавших антагонисты витамина К и планирующих беременность
4.1. Для женщин, нуждающихся в приёме АВК и планирующих беременность, рекомендуется чаще производить тесты на беременность и перевести их на НФГ или НМГ вместо варфарина с началом беременности (до 6-й недели беременности).
5. Профилактика ТЭО у женщин с протезированными клапанами сердца
5.1. Индивидуально подобранная доза НМГ дважды в день на протяжении всей беременности с целью поддерживать анти-Ха уровень через 4 ч после инъекции приблизительно равным 1,0-1,2 Ед/мл или рассчитывать по массе тела.
5.2. Либо агрессивное назначение индивидуально подобранных доз нефракционированного гепарина, т. е. введение подкожно каждые 12 ч в дозе, достаточной для поддержания средних терапевтичеких значений АЧТВ с минимум двукратным контролем или до достижения анти-Ха уровня 0,35-0,70 Ед/мл
5.3. Либо НМГ или НФГ (как описано выше) до 13-й недели, затем перевести на варфарин до середины 3-го триместра, с последующим возобновлением НФГ или НМГ. Далее антикоагулянты необходимо продолжать в послеродовом периоде.
5.4. Кроме того, женщинам с протезированными клапанами сердца с высоким риском рекомендуют низкие дозы аспирина (75-162 мг/д).
6. Профилактика ТЭО у женщин с сердечно-сосудистыми заболеваниями (кроме протезированных клапанов сердца)
6.1. Профилактическая антикоагулянтная терапия показана во время беременности женщинам с врождёнными тяжёлыми цианотическими заболеваниями сердца, при состояниях, сопровождающихся во время беременности сердечной недостаточностью III-IV функционального класса по NYHA, при выраженном митральном или аортальном стенозе, при выраженной лёгочной гипертензии.
Оценка эффективности и контроль за безопасностью антикоагулянтной терапии
При использовании НМГ определяют анти-Ха фактор через 3-4 ч после подкожного введения препарата:
Профилактическое назначение – 0,2-0,4 МЕ/мл;
терапевтическая доза – 0,5-1 МЕ/мл.
Через 12 ч уровни анти-Ха фактора должны составлять 0,1-0,3 МЕ/мл при профилактическом использовании НМГ и 0,2-0,4 при лечебной дозе.
Анти-Ха фактор определяют исходно до начала терапии НМГ, затем каждые 3 недели.
Всем пациенткам, получающим гепарины необходимо контролировать количество тромбоцитов: исходный уровень, затем еженедельно в течение трёх недель. Снижение количества тромбоцитов
Рекомендации по регионарной анестезии при родоразрешении у пациенток, получающих антикоагулянты
Отмена НМГ за 12-24 ч до родоразрешения (родовозбуждения или планового кесарева сечения).
Начинать терапию антикоагулянтами не ранее, чем через 10-12 ч после удаления эпидурального катетера, учитывая гемостазиологические тесты и общее состояние пациентки.
Использование общего интубационного наркоза в случае экстренного абдоминального родоразрешения беременных, получивших профилактическую дозу НМГ менее чем за 12 ч до операции и лечебную менее чем за 24 ч.
Несмотря на трудности проведения рандомизированных проспективных исследований по использованию НМГ, определению режимов антикоагулянтной терапии у беременных как НФГ, так и НМГ, в последние годы прочно входят в стандарты и рекомендации по ведению беременных с риском тромбоэмболических осложнений. НМГ ассоциируют с более низким уровнем материнской и перинатальной смертности, что в сочетании с высокой эффективностью и безопасностью, удобством использования делает их применение предпочтительным.
Данная статья подготовлена при поддержке компании ГлаксоСмитКляйн.
Рекомендуемая литература
1. Заболотских И.Б., Синьков С.В., Шапошников И.А. Диагностика и коррекция расстройств системы гемостаза: руководство для врачей//изд. «Практическая медицина» 2007; 335.
2. Кириенко А.И., Матюшенко А.А, Андреяшкин В.В. и др. Тромбоэмболия лёгочных артерий: диагностика, лечение и профилактика // Consillium medicum. 2001; 3: 6: 224-228.
3. Bates S.M., Greer I.A., Hirsh J., Ginsberg J.S. Use of antithrombotic agents during pregnancy: the Seventh ACCP Conference on Antithrombotic and Thrombolytic Therapy // Chest. 2004; 126: 3: Suppl: 627S-644S.
4. Boda Z., Laszlo P., Pfliegler G., Tornai I., Rejto L., Schlammadinger A. Thrombophilia, anticoagulant therapy and pregnancy // Orvosi Hetilap 1998; 139: 3113-16.
5. Сhan W.S., Anand S., Ginsberg J.S. Аnticoagulation of pregnant women with mechanical heart valves: a systematic review of the literature // Arch Intern Med. 2000; 160: 191-6.
6. Duhl A.J., Paidas M.J., Ural S.H. et al. Antithrombotic therapy and pregnancy: consensus report and recommendations for prevention and treatment of venous thrimboembolism and adverse pregnancy outcomes // Am J Obstet Gynecol. 2007; 197; 5: 457e1-457e21.
7. Greer I.A., Nelson-Piercy C. Low-molecular-weight hepatins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy // Blood. 2005; 106: 401-407.
8. Kupferminc M.J., Eldor A., Steinman N. et al. Increased frequency of genetic thrombophilia in women with complications of pregnancy // N Engl J Med. 1999; 340: 9-13.
9. Lindqvist P., Dahlback B. and Marsal K. Thrombotic risk during pregnancy: a population study // Obstet Gynecol. 1999; 94: 595-599.
10. Rey E., Kahn R.S., David M., Shrier I. Thrombophilic disorders and fetal loss: a meta-analysis // Lancet. 2003; 361: 901-908.
11. Rodie V.A., Tomson A.J., Stewart F.M., Quinn A.J., Walker I.D., Greer I.A. Low molecular weight heparin for the treatment of venous thromboembolism in pregnancy: a case series // BJOG. 2002; 109: 1022-1024.
В 70-е годы было обнаружено, что при деполимеризации обычного гепарина закономерно снижается его способность удлинять АЧТВ, при этом его способность инактивировать фактор Ха сохраняется. Дальнейшие исследования показали, что молекулы гепарина, содержащие меньше 18 сахаридных остатков (молекулярная масса меньше 5400 Д), не влияют на инактивацию тромбина антитромбином III, но сохраняют способность катализировать инактивацию фактора Ха. По меньшей мере 24 сахаридных остатка должно быть в молекуле гепарина (что соответствует молекулярной массе около 7200 Д), чтобы он мог ускорять инактивацию тромбина антитромбином III.
Иными словами, низкомолекулярные фракции гепарина (молекулярная масса меньше 7000 Д) обладают способностью нейтрализовать лишь фактор Ха, не изменяя при этом активности тромбина (т.е. фактора Па) .
Учитывая место тромбина и фактора Ха в "коагуляционном каскаде", можно ожидать, что в соответствии с усилительным механизмом образование одной молекулы фактора -Ха приведет к образованию множества молекул тромбина. Отсюда следует, что для торможения процесса свертывания крови на стадии образования фактора Ха требуется значительно меньше гепарина, чем на стадии образования тромбина. Как показывают расчеты, связывание 1 ЕД фактора Ха антитромбином предотвращает образованию 50 ЕД тромбина.
Антитромботическое (антикоагулянтное) действие антитромбина III, как показали исследования, в большей степени зависит от его способности тормозить активность фактора Ха, чем от способности инактивировать тромбин. Поэтому антитромботическое действие низко- и высокомолекулярных фракций гепарина теоретически должно быть одинаковым, если они в равной степени катализируют инактивацию фактора Ха антитромбином III. При одинаковой антитромботической активности низкомолекулярные фракции гепарина обладают целым рядом преимуществ перед высокомолекулярными его фракциями. Благодаря этим преимуществам низко молекулярные гепарины в последние годы получили довольно широкое распространение.
Во второй половине 80-х годов несколькими фармацевтическими фирмами были созданы различные препараты низкомолекулярных гепаринов. Для получения низкомолекулярных гепаринов используются разные методы ферментативной или химической деполимеризации обычного гепарина, которая неизбежно сопровождается его частичным десульфатированием, а значит, и снижением антикоагулянт ной активности.
Фармацевтические препараты низкомолекулярных гепаринов имеют молекулярную массу от 3400 до 6500 Д (табл. 11).
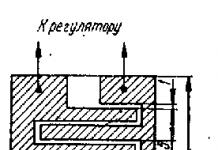
Таблица 11 Сравнительная характеристика низкомолекулярных гепаринов*
| Препарат (фирма-производитель, страна) | Патентованное название | Молекулярная масса, Д | Отношение активности против фактора Хай и против фактора IIа | Tl/2, мин |
| Ардепарин ("Wyeth-Ayerst", США) | Нормифло | 2,0:1 | ||
| Дальтепарин ("Kabi"), Швеция) | Фрагмин | 2,0:1 | 119-139 | |
| Надропарин ("Sanofi", Франция) | Фраксипарии | 3,2:1 | 132-162 | |
| Парнапарин ("Alfa Wassermann", Италия) | 2,4:1 | ? | ||
| Ревипарин ("Knoll", Германия) | Кливарин | 3,5:1 | ? | |
| Сандопарин ("Sandoz", Швейцария) | ? | ? | ||
| Тинзапарин ("Novo Nordisk", Дания) | Логипарин | 1,9:1 | ||
| Эноксапарин ("Rhone-Poulenc Rorer", Франция | Клексан Ловенокс | 3,7:1 | 129-180 |
* Данные литературы о молекулярной массе и биологической активности различных низкомолекулярных гепаринов разноречивы (см., например, J. Hirsh и М. Levine, 1992, 1994 г.г. и S. He.in.es и Я. Bussey, 1995 г., а также информационные материалы фармацевтических фирм-производителей)
? - сведения в литературе отстутствуют.
Различаясь по молекулярной массе, препараты низкомолекулярных гепаринов отлучаются друг от друга и по нейтрализующей активности в отношении фактора Ха и тромбина (т.е. фактора Па), что затрудняет сравнение их антикоагулянтной активности. Поэтому доза низкомолекулярных гепаринов часто выражается в условных единицах, принятых на фармацевтической фирме-производителе. Кроме того, низкомолекулярные гепарины различаются по соотношению активности против фактора Ха и против фактора Па. В то время как у обычного гепарина соотношение активности против фактора Ха и против фактора Па составляет 1:1, у низкомолекулярных гепаринов оно колеблется от 4:1 до 2:1. Для международного стандарта низкомолекурлярных гепаринов активность против фактора Ха определена в 168, ЕД/мг, для активности против фактора Па - в 68 ЕД/мг, т.е. соотношение активности против фактора Ха и против фактора Па составляет 2,47:1.
Таким образом, появилась необходимость стандартизации низкомолекулярных гепаринов, производимых в настоящее время разными фармацевтическими фирмами.
В многочисленных исследованиях установлены следующие особенности фармакокинетики и фармакодинамики низкомолекулярных гепаринов.
Во-первых, низкомолекулярные гепарины обладают более продолжительной антитромботической активностью, чем обычный гепарин. В то время как период полужизни в плазме крови (T1/2) обычного гепарина, если судить по его активности против фактора Ха, составляет 50-60 мин, T1/2 низкомолекулярных гепаринов после внутривенного введения колеблется от 1,5 до 4,5 ч. Значительная продолжительность антитромботического действия низкомолекулярных гепаринов позволяет назначать их 1 или 2 раза в сутки.
Во-вторых, биодоступность большинства низкомолекулярных гепаринов после глубокой подкожной инъекции составляет около 90%, в то время как у обычного гепарина - всего 15-20%. Поэтому в отличие от обычного гепарина низкомолекулярные гепарины можно назначать подкожно не только с профилактической, но и с лечебной целью.
В-третьих, механизмы и пути клиренса обычного гепарина и низкомолекулярных гепаринов различны. Как известно, в элиминации обычного гепарина после его внутривенного введения различают две фазы - быструю и медленную. Быстрая элиминация обычного гепарина из крови, как предполагают, обусловлена его связыванием с мембранными рецепторами эндотелиальных клеток и макрофагов. В этих клетrак происходят частичная деполимеризация и десульфатирование гепарина, после чего небольшие его фрагменты вы-
свобождаются в кровоток, а затем частично разрушаются в печени под действием гепариназы или выводятся почками. Фаза медленного клиренса, как считают, начинается тогда, когда происходит насыщение всех клеточных рецепторов для гепарина. Этими особенностями клиренса обычного гепарина объясняют тот факт, что T1/2 обычного гепарина зависит от вводимой дозы препарата. Так, после внутривенного болюсно-го введения гепарина в дозе 25 ЕД/кг Т1/2 составляет приблизительно 30 мин, после введения 100 ЕД/кг - 60 мин, а после введения 400 ЕД/кг - 150 мин. Клиренс низкомолекулярных гепаринов является более медленным и более равномерным чем обычного гепарина, что объясняют тем, что низкомолекулярные гепарины менее сульфатированы и поэтому хуже связываются с мембранами эндотелиальных клеток и плазменными белками. Выведение почками, как полагают, служит основным путем элиминации низкомолекулярных гепаринов из организма. При почечной недостаточности T1/2 низкомолекулярных гепаринов значительно удлиняется.
В-четвертых, низкомолекулярные гепарины в значительно меньшей степени, чем обычный гепарин, связываются с плазменными белками (например, с богатым гистидином гликопротеидом, фактором 4 тромбоцитов и т.д.), которые способны нейтрализовать их антитромботическую активность. Низким сродством низкомолекулярных гепаринов к гепариннейтрализующим плазменным белкам объясняют их высокую биодоступность при назначении в низких дозах и большую предсказуемость антикоагулянтного ответа на высокие дозы.
Все указанные особенности фармакокинетики и фармако-динамики низкомолекулярных гепаринов обусловливают их несомненное преимущество перед обычным гепарином, которое заключается в том, что как с профилактической, так и с лечебной целью они могут назначаться подкожно в постоянной дозе.
Другое преимущество низкомолекулярных гепаринов по сравнению с обычным гепарином - это низкая частота раз вития тромбоцитопении. Так как способность вызывать aгрегацию тромбоцитов более выражена у высокомолекулярных фракций гепарина, включая обычный гепарин, у больных с исходной тромбоцитопенией в качестве прямых антикоагулянтов лучше использовать низкомолекулярный гепарин. В то же время не следует назначать низкомолекулярные гепарины больным с индуцированной обычным гепарн ном тромбоцитопенией из-за высокой частоты перекрестные реакций с гепарин-зависимыми антителами. Для лечени больных с индуцированной гепарином тромбоцитопение рекомендуется использовать гепариноид данапароид или прямые ингибиторы тромбина (например, рекомбинантны гирудин).
Основная область клинического применения низкомолекулярных гепаринов - профилактика венозных тромбозе у ортопедических, хирургических, неврологических и терапевтических больных с высоким риском развития тромбоза глубоких вен нижних конечностей и таза. По сводным данным, по эффективности в отношении профилактики тромбе за глубоких вен нижних конечностей и легочной эмболии! ортопедических и хирургических больных низкомолекуляные гепарины (в частности, эноксипарин) не уступают обычному гепарину или даже несколько превосходят его. Про ортопедических операциях, когда особенно высок риск раз вития тромбоза глубоких вен нижних конечностей, профилактическое применение низкомолекулярных гепаринов позволяет значительно (на 25%) снизить риск развития флеботромбоза и недостоверно (на 24%) снизить риск возникновения ТЭЛА по сравнению с обычным гепарином без заметного увеличения риска развития серьезных кровотечений (относительный риск 1,19).
Низкомолекулярные гепарины с успехом применяют при лечении тромбоза глубоких вен таза и нижних конечностей Установлено, что при тромбозе глубоких вен нижних конечностей подкожное введение постоянной дозы низкомолекулярного гепарина по эффективности превосходит инфузионную терапию обычным гепарином под контролем АЧТВ. Наряду с более выраженным улучшением клинических и ангиографических проявлений флеботромбоза, терапия низкомолекулярными гепаринами сопровождается значительным снижением частоты повторных венозных тромбоэмболий (на 50% и кровотечений (более чем на 59%).
Опыт применения низкомолекулярных гепаринов с лечебной целью невелик. Так, недостаточно исследована их эффективность при нестабильной стенокардии - синдроме, при лечении которого обычный гепарин является препаратом выбора.
Недавние исследования показали, что низкомолекулярные гепарины могут быть эффективными при лечении острой ТЭЛА (C.Thery и соавт., 1992 г.).
В двух контролируемых исследованиях получены доказательства того, что курсовая терапия низкомолекулярным гепарином (в частности, дальтепарином и эноксапарином) в сочетании с физическими тренировками улучшает коллатеральное кровообращение у больных ИБС со стабильной стенокардией напряжения (A. Quyyumi и соавт., 1993 г.; М. Fujita и соавт., 1995 г.).
Противопоказания к назначению и побочные эффекты низкомолекулярных гепаринов такие же, как у обычного гепарина.
Сулодексид (вессел)
Сулодексид (коммерческое название: вессел) - это антитромботический препарат, который содержит два гликозаминогликана, выделяемых, по оригинальной технологии из слизистой оболочки кишечника свиньи, - быструю фракцию Опарина ^80% ) и дерматана сульфат (20%).
Как известно, при электрофорезе гепарин, выделенный из слизистой оболочки кишечника свиньи, можно разделить на две основные фракции - быструю (быстро движущуюся) и
медленную (медленно движущуюся). Быстрая фракция гепарина имеет молекулярную массу около 7000 Д, что в количественном отношении сближает ее с низкомолекулярными гепаринами, получаемыми при деполимеризации обычного гепарина. В качественном же отношении между быстрой фракцией гепарина, выделенной при электрофорезе, и низкомолекулярными гепаринами, полученными при деполимеризации обычного гепарина, имеется большое различие. Это различие обусловлено тем, что в процессе деполимеризации обычного гепарина происходит его частичное десульфатирование, что одновременно сопровождается снижением его биологической активности. Иными словами, несмотря на то что молекулярные массы быстрой фракции гепарина и низкомолекулярных гепаринов в значительной мере сходны, первая обладает более выраженной антитромботической активностью, поскольку содержит большее число сульфатных групп.
Кроме быстрой фракции гепарина, которая инактивирует тромбин, фактор Ха и другие сериновые протеазы при участии антитромбина III, сулодексид содержит дерматан, который нейтрализует активность этих протеаз при участии кофактора гепарина II.
Таким образом, сулодексид обладает двойным механизмом антитромботического действия, связанным с его двухкомпонентным составом.
Несомненным преимуществом сулодексида по сравнению с обычным гепарином и низкомолекулярными гепаринами является его эффективность не только при парентеральном введении, но и при приеме внутрь. Поэтому область клинического применения сулодексида гораздо шире, чем других зависимых от антитромбина III ингибиторов тромбина.
Сулодексид имеет следующие показания к применению:
1) профилактика тромбоза глубоких вен нижних конечностей, а значит, и ТЭЛА. В контролируемых исследованиях доказана высокая профилактическая эффективность сулодексида при внутримышечного или внутривенном введении по 750 ЕД 2 раза в сутки;
2) лечение тромбоза глубоких вен и/или ТЭЛА. Опыта применения препарата для лечения этих тромбоэмболических заболеваний, насколько известно, нет, однако теоретически клиническая эффективность сулодексида должна быть такой же, как обычного гепарина или низкомолекулярных гепаринов;
3) вторичная профилактика после острого инфаркта миокарда. Профилактическая эффективность сулодексида после ИМ, была продемонстрирована в крупном многоцентровом исследовании, включавшем 3986 больных. Рандомизация больных проводилась на 7 - 10-й день заболевания, после чего 2016 больных основной группы в течение 1 мес получали 600 ЕД сулодексида внутримышечно, затем по 500 ЕД 2 раза в день внутрь. 1970 больных составили контрольную группу. Срок наблюдения был не менее 12 мес. В группе больных, получавших сулодексид, отмечено достоверное снижение общей смертности на 32%) и частоты случаев повторного ИМ (на 28%), а также риска развития пристеночного тромбоза левого желудочка (на 53%). Значительно (на 56%), но статистически недостоверно снизилась частота развития ТЭЛА (М. Condorelli и соавт., 1994 г.);
4) лечение облитерирующего атеросклероза нижних конечностей. В нескольких контролируемых исследованиях убедительно продемонстрировано, что как внутривенные курсы лечения сулодексидом (600 ЕД/сут в течение 2-4 нед.), так и длительный его прием внутрь (по 250 - 500 ЕД 2 раза в день) вызывают симптоматическое улучшение и улучшение кровообращения в нижних конечностях, подтверждаемое методами допплеро- и реоплетизмографии. При этом наблюдается значительное уменьшение вязкости плазмы крови, в основном за счет снижения концентрации фибриногена в плазме крови. У больных с гиперлипидемией IIB и IV типов сулодексид приводит к достоверному снижению уровней триглицеридов в плазме крови, по-видимому, благодаря присущей всем гепаринам способности стимулировать липопротеидлипазу; кроме того, у больных с гиперлипидемией
IV типа препарат повышает уровень антиатерогенного холе стерина липопротеидов высокой плотности. Таким образом, помимо высокой антитромботической активности, сулодексид может улучшать реологические свойства крови и оказывать гиполипидемическое (антиатерогенное) действие;
5) профилактика тромбоза аортокоронарных шунтов. Предварительные результаты рандомизированного исследования свидетельствуют, что профилактическая эффективность сулодексида (500 ЕД/сут) после операции аортокоронарного шунтирования по меньшей мере не уступает таковой комбинации аспирина (300 мг/сут) и дипиридамола (400 мг/сут). После 15-месячной терапии при коронароангиографии выявлена окклюзия 5 из 54 (9,3%) шунтов у больных, получавших сулодексид, и 5 из 30 (16,7%) шунтов у больных, получавших аспирин в сочетании с дипиридамолом (различия между группами не были достоверными из-за небольшого числа наблюдений; S. Saccani и соавт., 1993 г.).
Сулодексид хорошо переносится больными; побочные явления, в первую очередь геморрагические осложнения, встречаются крайне редко (0,5-1,3%). В самом крупном исследовании у более 2000 больных, получавших сулодексид в течение не менее 12 мес, наблюдалось всего 2 случая возникновения гематомы в месте внутримышечного введения препарата, 12 случаев желудочно-кишечных расстройств (тошнота, рвота, боли в животе и т.д.) и 2 случая кожных высыпаний.
При парентеральном введении сулодексида так же, как и при лечении другими зависимыми от антитромбина III ингибиторами тромбина, рекомендуют определять АЧТВ и тромбиновое время. При пероральной терапии контроль за показателями гемостаза используется редко.
Другим оригинальным антитромботическим препаратом, созданным в 80-е годы, является данапароид
Данапароид
Данапароид (коммерческие названия: оргаран, ломопарин) - это низкомолекулярный гепарид, представляющий собой смесь различных гликозаминогликанов, которую по оригинальной технологии выделяют из слизистой оболочки свиньи. Основным компонентом данапароида является гепарана сульфат (около 80%); кроме того, в препарате содержатся дерматан, хондроитин и некоторые низкомолекулярные фракции гепарина.
Средняя молекулярная масса данапароида 6500 Д. Несмотря на то, что данапароид содержит гепарин, он не обладает антитромбиновой активностью. Его специфическая активность в отношении фактора Ха приблизительно в 10 раз ниже, чем активность низкомолекулярных гепаринов, зато эта активность является намного более избирательной. В то время как у низкомолекулярных гепаринов соотношение активности против фактора Ха и против фактора Па (т.е. тромбина) колеблется от 2:1 до 4:1, у данапароид это соотношение равно 20:1. Важным достоинством препарата является его продолжительный Т1/2, составляющий около 14 ч. Биодоступность препарата после подкожного введения достигает 100%.
Как и низкомолекулярные гепарины, данапароид применяется в основном с целью профилактики тромбоза глубоких вен нижних конечностей и тромбоэмболических осложнений у ортопедических, хирургических, неврологических и терапевтических больных. По данным разных авторов, двукратное подкожное введение данапароид позволяет снизить риск развития тромбоза глубоких вен в 3-4 раза по сравнению с плацебо, в 2-3 раза по сравнению с декстраном-70 и в 1,5-3 раза по сравнению с обычным гепарином. Частота геморрагических осложнений при применении данапароида такая же или ниже, чем при обычной гепаринотерапии. Данапароид не вызывает агрегации тромбоцитов и поэтому может использоваться у больных с исходной или индуцированной гепарином тромбоцитопенией. Имеется опыт успешного применения данапароида для лечения тромботических осложнений у 5 больных, которым антикоагулянтная терапия была противопоказана из-за геморрагического инсульта.
У гепарина и его производных или аналогов есть несколько существенных недостатков, которые в некоторых случаях могут заметно ослаблять их антитромботическую активность. Во-первых, гепарины и гепариноиды нейтрализуют тромбин и другие факторы свертывающей системы крови только при наличии антитромбина III, уровни которого снижены у больных с наследственным его дефицитом и при ряде других заболеваний и состояний (в частности, во время терапии высокими дозами обычного гепарина). Во-вторых, гепарин может инактивироваться фактором 4 тромбоцитов и гепариназой, а фибринмономеры при тромбогенных состояниях могут защищать тромбин от инактивации комплексом гепарин - антитромбин III. В-третьих, что, по-видимому, особенно важно, комплекс гепарин - антитромбин III гораздо слабее инактивирует связанный с фибрином тромбин, чем несвязанный тромбин, циркулирующий в крови.
Всех этих недостатков лишены созданные в последние годы прямые ингибиторы тромбина, прототипом для которых послужил нативный гирудин. В противоположность гепаринам и гепариноидам антитромботическое действие прямых ингибиторов тромбина не зависит от присутствия в плазме крови антитромбина III; фактор 4 тромбоцитов и гепариназа печени не изменяют их активности; они эффективно инактивируют тромбин, связанный с фибриновым тромбом, т.е. оказывают более избирательное действие на тромбообразование.
Таким образом, прямые ингибиторы тромбина по сравнению с гепарином и его аналогами обладают рядом важных преимуществ, которые делают весьма перспективным применение этих довольно дорогих лекарственных препаратов при лечении заболеваний или состояний, при которых гепарино-терапия оказывается недостаточно эффективной, например в остром периоде ИМ или после коронарной ангиопластики.
Гирудин.
Гирудин. Как известно, с лечебной целью пиявки (Hirudo medicinalis) использовали еще в Древней Греции, однако антикоагулянтное действие слюны пиявок впервые были описаны J- Haycraft в 1884 г. В 50-е годы нашего столетия F. Mark-ivardt удалось выделить в чистом виде вещество гирудин, а в 80-е годы после определения его химической структуры стало возможным промышленное производство этого препарата благодаря применению ДНК-рекомбинантного метода.
Гирудин представляет собой полипептид, содержащий 65 или 66 аминокислотных остатков, с молекулярной массой около 7000 Д. Он является самым сильным и специфическим ингибитором тромбина, с которым быстро соединяется, образуя стабильный комплекс. Гирудин предотвращает все эффекты тромбина - не только превращение фибриногена в фибрин, но и активацию факторов V, VIII и XIII. В отличие от гепарина он тормозит индуцированную тромбином агрегацию тромбоцитов. Гирудин - селективный индуктор тромбина; в противоположность гликозаминогликанам он не подавляет активности других сериновых протеаз.
Существует по меньшей мере три варианта нативного гирудина, которые незначительно различаются по количеству аминокислотных остатков, но обладают одинаковой антикоагулянтной активностью. Соответственно разные фармацевтические фирмы производят различные варианты рекомби-нантного гирудина. Швейцарская фирма "Ciba-Geig-y", например, выпускаетрекомбинантный десульфатогирудин (CGP 39393), который идентичен нативному гирудину, за исключением отсутствия сульфогруппы у тирозина в положении 63.
Фармакологические свойства рекомбинантного десульфатогирудина хорошо изучены в опытах на животных, а также У здоровых лиц (добровольцы), больных ИБС со стенокардией напряжения. Установлено, что препарат эффективен как при внутривенном, так и при подкожном введении. После подкожной инъекции рекомбинантный гирудин быстро всасывается в кровь; удлинение АЧТВ наблюдается уже через 30 мин, причем степень его зависит от введенной дозы препарата. Через 30 мин АЧТВ удлиняется примерно в 1,5 и 2 раза после подкожного введения гирудина в дозах 0,2 и 0.4 мг/кг соответственно. Максимальное удлинение АЧТВ происходит между 3-м и 4-м часом. Через 8 ч после подкожной инъекции АЧТВ остается удлиненным, затем постепенно нормализуется к 24-му часу. Желаемого удлинения АЧТВ в 1,7-1,9 раза по сравнению с нормальными значениями удавалось достичь при подкожном введении гирудина в дозе 0,3-0,5 мг/кг 2 или 3 раза в сутки (М. Verstraete и соавт., 1993 г.).
Для поддержания АЧТВ на уровне в 1,5-2 раза выше нормы при внутривенном введении гирудина скорость его инфузии должна составлять 0,02-0,05 мг/кг в час. Значения АЧТВ хорошо коррелируют с концентрациями гирудина в плазме крови, поэтому считается, что определение АЧТВ - наиболее подходящий показатель для лабораторного контроля за лечением рекомбинантным гирудином (Р. Zoldhelyi и соавт., 1993 г.).
Недавно в рандомизированном исследовании было проведено сравнение эффективности рекомбинантного десульфатогирудина и гепарина у 246 больных острым ИМ, получавших тромболитический препарат и аспирин. Через 18-36 ч после тромболитической терапии частота проходимости инфаркта коронарной артерии в группе больных, получавших гирудин, была достоверно выше (97,8% против 89,2%, р=0,01), а частота реокклюзии - недостоверно ниже (1,6% против 6,7% ;р==0,07), чем у больных, леченных гепарином. За период пребывания в стационаре в группе из 162 больных, получавших гирудин, было 11 случаев смерти или повторного ИМ (6,8%), тогда как в группе из 84 больных, получавших гепарин, - 14 таких случаев (16,7%;
р=0,02; С. Cannon и соавт., 1994 г.). Таким образом, предварительные результаты свидетельствуют, что рекомбинантный гирудин является более эффективным прямым антикоапянтом чем гепарин, и может оказаться перспективным в качестве дополнительного препарата при тромболитической терапии острого ИМ.
По данным повторной ангиографии, рекомбинантный гиодином более эффективно, чем гепарин, предотвращает тромбообразование в коронарных артериях у больных ИБС с нестабильной стенокардией (E.Topol и соавт., 1994 г.).
Доказана профилактическая эффективность подкожного введения рекомбинантного гирудина (15-20 мг 2 раза в сутки) у ортопедических больных с высоким риском развитие тромбоэмболических осложнений. В группе больных, получавших гирудин, частота тромбоэмболических осложнений была ниже, чем в группе больных, получавших обычный или низкомолекулярный гепарин (В. Erickson и соавт., 1993 г.).
Гируген - синтетический аналог гирудина, являющийся по химической структуре додекапептидом. Исследования in vivo показали, что по антитромботической активности гируген значительно уступает гирудину и гирулогу, поэтому от его клинического применения отказались.
Гирулог представляет собой группу пептидов, которые, как и гирудин, обладают свойствами прямого ингибитора тромбина, но способны связывать меньшее число активных центров тромбина. Наиболее хорошо изучена эффективность одного то этих пептидов - гирулога-1. Установлено, что гирулог может быть полезным при лечении нестабильной стенокардии, после коронарной ангиопластики и у больных после трансплантации коленного сустава с высоким риском развития тромбоэмболических осложнений.
В последние годы синтезировано большое число олигопептидов со свойствами прямого ингибитора тромбина. По химической структуре их можно разделить на 3 группы:
а) производные аргинина (РРАСК, аргатробан, новастан и ДР-); б) производные бензамидина (тромстоп); в) производные лизина.
Существуют определенные различия в механизме анти-тромбинового действия этих олигопептидов. Так, РРАСК является необратимым ингибитором тромбина, тогда как аргатробан - обратимый конкурентный его ингибитор. В клинических исследованиях недавно изучалась эффективность внутривенного введения аргатробана при нестабильной стенокардии. Аргатробан эффективно устранял как клинические, так и электрокардиографические проявления ишемии миокарда, однако после прекращения инфузии препарата у 9 из 43 больных приступы стенокардии возобновились (Н. Gold и соавт., 1993 г.). Такой же феномен отмены, или "реактивации" нестабильной стенокардии, как известно, описали Р. Theroux и соавт. (1992 г.) после прекращения гепаринотерапии. Механизмы феномена "реактивации" после прекращения терапии гепарином или аргатробаном требуют дальнейшего изучения, поскольку этот феномен не встречался у больных ИБС с нестабильной стенокардией после лечения гирудином или гирулогом.
В связи с высокой стоимостью прямых ингибиторов тромбина по сравнению с гепарином (например, 3-дневный курс внутривенной терапии гирудином стоит более 2.000 долларов США) область их клинического применения в настоящее время весьма ограничена.
Низкомолекулярные гепарины - препараты короткоцепочечных мукополисахаридов с молекулярной массой 4000-7000 дальтон. В отличие от нефракционированного, низкомолекулярные гепарины оказывают антитромботическое действие, ингибируя преимущественно фактор Ха, а не Па.
Аититромботическая активность гепарина и степень влияния препарата на свертываемость крови зависят от того, какие полисахариды входят в его состав. В определенной мере об избирательности действия низкомолекулярных гепаринов можно судить по соотношению их влияния на факторы Ха и Па.
Гепарины, имеющие очень короткие иолисахаридные цепи и очень низкую молекулярную массу, не дают аптитромботи-ческого эффекта. Гепарины, имеющие полисахаридные цепи длиной более 18 сахарных единиц и молекулярную массу более 5400 дальтон, ингибируют тромбин (фактор Па), что увеличивает опасность возникновения кровотечений. При длине полисахаридных цепей от 8 до 18 сахарных единиц препараты в основном подавляют фактор Ха, т. е. проявляют аититромбо-тическую активность при минимальном риске развития кровотечения.
Достоинство низкомолекулярных гепаринов - их способность тормозить свертывание крови на более высокой ступени (на уровне фактора Ха, а не Па) и уменьшать образование тромбина.
Биодоступность пизкомолекулярных гепаринов достигает почти 100 %; при этом их период полу выведения в 2-4 раза превышает таковой у нефракционированного гепарина. L. Wallentin (1996), C.J. Dunn и Е. М. Sorkin (1996) считают, что низкомоле-
кулярные гепарииы дают более предсказуемый, продолжительный и избирательный эффект, благодаря чему их можно назначать 1-2 раза в сутки, а также непосредственно в пред- и постоперационные периоды.
За счет вышеуказанных свойств облегчается проведение адекватной терапии у больных с острым коронарным синдромом. Вместо постоянного внутривенного введения нефракциониро-ваиного гепарина, требующего обязательного подбора скорости вливания в зависимости от АЧТВ, достаточно 1-2 подкожных инъекций низкомолекуляриого гепарина в 1 сут.
Принципиальное значение имеет то обстоятельство, что лечение низкомолекулярными гепаринами может быть длительным и осуществляться не только в стационарных, но и в амбулаторных условиях. Это особенно важно при нестабильной стенокардии, т. к. в исследовании RISC (1990) убедительно доказано, что вероятность текущей или рецидивирующей ишемии остается высокой на протяжении 6-12 нед с момента дестабилизации заболевания.
При остром тромбозе низкомолекулярные гепарины могут менее эффективно сдерживать распространение тромба по срав нению с нефракционированным, вследствие преимущественного влияния на фактор Ха, а не Па.
Сопоставить некоторые свойства нефракционированного и низкомолекулярных гепаринов можно на основании данных, приведенных в табл. 4.3.
Показания к назначению разных низкомолекулярных гепаринов не имеют принципиальных различий и аналогичны таковым у нефракционированного гепарина.
При назначении низкомолекулярных гепаринов пожилым пациентам разовую и суточную дозы препаратов уменьшают.
Низкомолекуляриые гепарины с осторожностью назначают при тяжелом нарушении функции печени и почек, выраженной артериальной гипертензии, ретинопатии, кровоизлиянии в стекловидное тело, после хирургических вмешательств, особенно на головном или спинном мозге.
Побочные эффекты: кровотечения, в первые дни лечения возможны умеренная асимптоматическая тромбоцитопения, местные или системные аллергические реакции. Может отмечаться обратимое повышение активности печеночных ферментов. В области инъекции иногда появляются покраснение, болезненность
или плотные узлы, которые рассасываются самостоятельно, без прекращения лечения. В редких случаях в месте инъекции развивается некроз.
Противопоказано назначение низкомолекулярных гепаринов при понижении свертывания крови различного генеза; эрозивно-язвенном поражении желудочно-кишечного тракта в фазе обострения, особенно с тенденцией к кровотечению; септическом эндокардите; спинальной или эпидуралыюй пункции, травме ЦНС, органов зрения, слуха и хирургических вмешательствах на этих органах; симпатической блокаде; повышенной чувствительности к гепарину.
Дальтепарин (фрагмин) при остром тромбозе глубоких вен или ТЭЛА назначают внутривенно или подкожно 100 МЕ/кг каждые 12 ч. Продолжительность лечения в среднем составляет 5-7 дней.
Методика применения фрагмина при нестабильной стенокардии и инфаркте миокарда без Q изложена в главе 5.
Для профилактики тромбоэмболических осложнений при хирургических операциях - подкожно 2500 ME за 1-2 ч до операции, затем в той же дозе ежедневно утром в течение 5-7 дней.
При наличии множественных факторов риска тромбоэмболии или при ортопедических операциях - 2500 ME подкожно за 1 -2 ч до операции, затем в той же дозе через 12ч после операции, далее - по 5000 ME подкожно утром ежедневно в течение 5- 7 дней.
Для профилактики свертывания крови при длительном (более 4 ч) проведении гемодиализа (гемофильтрации) - внутривенно струйно 30-40 МЕ/кг, затем со скоростью 10-15 МЕ/(кг X ч). При острой почечной недостаточности у больных с высоким риском развития кровотечения - внутривенно струйно в дозе 5- 10 МЕ/кг, а затем со скоростью 4-5 МЕДкг X ч).
При передозировке в случае необходимости используют про-тамин сульфат (из расчета, что 1 мг протамина нейтрализует 100 ME фрагмина).
Надропарин (фраксипарин) вводят в подкожную клетчатку живота, инъекцию делают перпендикулярно поверхности кожной складки.
Методика применения фраксипарина при нестабильной стенокардии и инфаркте миокарда без Q изложена в главе 5.
Для профилактики тромбоэмболии в общей хирургии - 0,3 мл за 2-4 ч до операции, далее по 0,3 мл 1 раз в сутки в течение 7 дней.
В ортопедии профилактическую дозу подбирают с учетом массы тела. Пациентам с массой менее 50 кг в предоперационный период и 3 дня после операции вводят ежедневно по 0,2 мл, а с 4-го дня - по 0,3 мл в сутки. Пациентам с массой тела 51-70 кг в предоперационный период и 3 дня после операции - по 0,3 мл, а с 4-го дня - по 0,4 мл в сутки. При массе тела 71 -95 кг - соответственно по 0,4 мл, а с 4-го дня - по 0,6 мл в сутки.
Для лечения тромбозов препарат вводят каждые 12 ч в тече ние 10 дней. Дозу определяют в зависимости от массы тела паци-
ента. При массе тела 45 кг она составляет 0,4 мл; до 55 кг - 0,5 мл; до 70 кг - 0,6 мл; до 80 кг - 0,7 мл; до 90 кг - 0,8 мл; 100 кг-0,9 мл.
При передозировке в случае необходимости используют про-тамин сульфат (из расчета, что 0,6 мл протамина нейтрализуют 0,1 мл фраксипарина).
Эноксапарин (клексан) назначают подкожно в передне- или заднелатеральную поверхность брюшной стенки на уровне поясничной области. Инъекцию осуществляют перпендикулярно кожной складке, место инъекции нельзя растирать. При гемодиализе препарат вводят в артериальную линию.
В масштабных исследованиях клексана при ИБС выявлены высокая эффективность и безопасность клексана как при лечении острого коронарного синдрома, так и для профилактики тромбоза коронарного стента. Методика применения клексана при нестабильной стенокардии и инфаркте миокарда без Q изложена в главе 5,
Для профилактики венозных тромбозов у пациентов с умеренным риском развития тромбоэмболии - по 20 мг (0,2 мл) 1 раз в сутки; с высоким риском - 40 мг (0,4 мл) 1 раз в сутки.
При хирургических вмешательствах у пациентов с умерен ным риском развития тромбоэмболии - 20 мг за 2 ч до операции, а затем по 20 мг 1 раз в сутки в течение 7 дней; с высоким риском (ортопедия) - 40 мг за 12 ч до операции, а затем по 40 мг 1 раз в сутки в течение 7-10 дней.
Для лечения тромбоза глубоких вен - по 1 мг/кг каждые 12 ч в течение 10 дней с одновременным назначением непрямых антикоагулянтов.
Для предупреждения коагуляции в системе экстракорпоральной циркуляции при гемодиализе - 1 мг/кг (при 4-часовой процедуре) в артериальную линию в начале гемодиализа. У пациентов с высоким риском кровотечения дозу уменьшают до 0,5 мг/кг.
Препарат нельзя вводить внутримышечно.
При передозировке можно использовать протамин сульфат (из расчета, что 1 мг протамина нейтрализует 1 мг клексана).
Сулодексид (вессел дуэ ф) - гликозаминогликан, состоящий из гепариноиодобной (около 80 %) и дерматаиовой фракций. За счет низкомолекуляриой (гепариноподобной) фракции сулодексид подавляет фактор Ха и, в меньшей степени, Па, т. е. про-
являет преимущественно антитромботический, а не антикоагу-лянтный эффект; за счет дерматановой фракции - оказывает нормализующее действие на сосудистую проницаемость.
Основной эффект вессела дуэ ф - нормализация состояния сосудистой стенки. Это связано с высоким тропизмом препарата к эндотелию (концентрация вессела дуэ ф в эндотелии в 20-30 раз превосходит таковую в других тканях) и с физиологической ролью эндотелиальных гликозаминогликанов.
Назначают вессел дуэ ф в первые 10-20 дней по 600 ЛЕ (единиц активности по высвобождению липопротеинлипазы, липа-семичсских единиц) 1 раз в сутки внутримышечно, а далее по 250 ЛЕ 2 раза в сутки в капсулах повторными курсами по 30-40 дней либо непрерывно в течение 6-12 мес.
Наличие лекарственной формы препарата для приема внутрь имеет особое значение в случаях, когда важно обеспечить длительную антитромботическую терапию. Результаты, полученные при назначении вессела дуэ ф для вторичной профилактики инфаркта миокарда, весьма обнадеживают (глава 6).
Состав и форма выпуска
в блистере 2 шприца одноразовых по 0,3 мл; в коробке картонной 1 или 5 блистеров.
в блистере 2 шприца одноразовых по 0,4 мл; в коробке картонной 1 или 5 блистеров.
в блистере 2 шприца одноразовых по 0,6 мл; в коробке картонной 1 или 5 блистеров.
в блистере 2 шприца одноразовых по 1 мл; в коробке картонной 1 или 5 блистеров.
Описание лекарственной формы
Прозрачный, слегка опалесцирующий, бесцветный или светло-желтый раствор.
Характеристика
Низкомолекулярный гепарин (НМГ).
Фармакологическое действие
Фармакологическое действие — антитромботическое, антикоагулянтное .Фармакодинамика
Надропарин кальция характеризуется более высокой анти-Ха факторной по сравнению с анти-IIа факторной или антитромботической активностью. Отношение между двумя активностями для надропарина находится в пределах 2,5-4.
В профилактических дозах надропарин не вызывает выраженного снижения активированного частичного тромбинового времени (АЧТВ ) .
При курсовом лечении в период максимальной активности АЧТВ может быть удлинено до значения, в 1,4 раза превышающее стандартное. Такая пролонгация отражает остаточный антитромботический эффект надропарина кальция.
Фармакокинетика
Фармакокинетические свойства определяются на основе изменения анти-Ха факторной активности плазмы. После п/к введения почти 100% препарата быстро всасывается. C max в плазме достигается между 3 и 4 ч, если надропарин кальция применяют в режиме 2 инъекции в сутки. При применении надропарина кальция в режиме 1 инъекция в сутки C max достигается между 4 и 6 ч после введения. Метаболизм происходит в основном в печени (десульфатирование, деполимеризация). После п/к введения T 1/2 анти-Ха факторной активности низкомолекулярных гепаринов выше, чем в случае нефракционированных гепаринов и составляет 3-4 ч.
Что касается анти-IIа факторной активности, при применении низкомолекулярных гепаринов она исчезает из плазмы быстрее, чем анти-Ха факторная активность.
Выведение происходит прежде всего почками, в исходной или малоизмененной форме.
Группы риска
У пожилых больных, поскольку функция почек физиологически снижена, элиминация замедляется. Это не влияет на дозы и режим введения препарата с профилактической целью до тех пор, пока функция почек этих больных остается в приемлемых пределах, т.е. нарушена незначительно.
До начала лечения НМГ следует систематически проводить оценку почечной функции пожилых больных в возрасте старше 75 лет, используя формулу Кокрофта.
Слабая до умеренной почечная недостаточность (Cl >30 мл/мин): в некоторых случаях может быть полезным контролировать уровень анти-Ха факторной активности в крови для исключения возможности передозировки при курсовом применении препарата.
Гемодиализ: низкомолекулярный гепарин вводится в артериальную линию петли диализа в достаточно высоких дозах, для того чтобы предотвратить свертывание крови в петле. В принципе, фармакокинетические параметры не изменяются, за исключением случая передозировки, когда прохождение препарата в системное кровообращение может вести к повышению анти-Ха факторной активности, связанному с конечной фазой почечной недостаточности.
Показания препарата Фраксипарин
Профилактика тромбообразования при хирургических вмешательствах, свертывания крови в системе экстракорпорального кровообращения во время гемодиализа или гемофильтрации, тромбоэмболических осложнений у больных с высоким риском тромбообразования (при острой дыхательной и/или сердечной недостаточности в условиях отделения интенсивной терапии).
Лечение тромбоэмболий, нестабильной стенокардии и инфаркта миокарда без зубца Q.
Противопоказания
Повышенная чувствительность (в т.ч. тромбоцитопения) к Фраксипарину или другим НМГ и/или гепарину в анамнезе; признаки кровотечения или повышенный риск кровотечения, связанный с нарушением гемостаза, за исключением синдрома ДВС , не вызванного гепарином; органические поражения органов со склонностью к кровоточивости (например, острая язва желудка или двенадцатиперстной кишки); травмы или оперативные вмешательства на ЦНС; септический эндокардит.
Применение при беременности и кормлении грудью
Опыты на животных не показали тератогенного эффекта надропарина кальция, тем не менее в I триместре беременности предпочтительно избегать назначения Фраксипарина как в профилактической дозе, так и в форме курсового лечения.
В течение II и III триместров беременности Фраксипарин может быть использован только в соответствии с рекомендациями врача для профилактики венозного тромбоза (при сопоставлении пользы для матери с риском для плода). Курсовое лечение в этот период не применяют.
Если стоит вопрос о применении эпидуральной анестезии, рекомендуется, насколько это возможно, приостановить профилактическое лечение гепарином, по крайней мере, за 12 ч до анестезии.
Поскольку всасывание препарата в ЖКТ у новорожденных в принципе маловероятно, лечение Фраксипарином кормящих матерей не противопоказано.
Побочные действия
Наиболее частый побочный эффект — образование подкожной гематомы в месте инъекции. В некоторых случаях наблюдается появление плотных узелков, не означающих инкапсулирование гепарина, которые исчезают через несколько дней.
Большие дозы Фраксипарина могут провоцировать кровотечения различных локализаций и легкую тромбоцитопению (тип I), которая обычно исчезает в процессе дальнейшей терапии. Возможно временное умеренное повышение уровня печеночных ферментов (АЛТ, АСТ).
Некроз кожи и аллергические реакции возникают редко. Сообщалось о нескольких случаях анафилактических реакций и иммунной тромбоцитопении (тип II), сочетающейся с артериальным и/или венозным тромбозом или тромбоэмболией.
Взаимодействие
Развитие гиперкалиемии может зависеть от одновременного присутствия нескольких факторов риска. Лекарственные препараты, вызывающие гиперкалиемию: соли калия, калийсберегающие диуретики, ингибиторы АПФ , блокаторы рецепторов ангиотензина II, НПВС , гепарины (низкомолекулярные или нефракционированные), циклоспорин и такролимус, триметоприм. Опасность развития гиперкалиемии повышается при комбинации вышеупомянутых средств с Фраксипарином.
Совместное применение Фраксипарина с такими препаратами, влияющими на гемостаз, как ацетилсалициловая кислота, НПВС , антагонисты витамина К, фибринолитики и декстран, приводит к взаимному усилению эффекта.
Кроме того, следует принимать во внимание, что ингибиторы агрегации тромбоцитов (кроме ацетилсалициловой кислоты в качестве анальгетического и жаропонижающего ЛС , т.е. в дозе свыше 500 мг): НПВС , абциксимаб, ацетилсалициловая кислота в антиагрегантных дозах (50-300 мг) при кардиологических и неврологических показаниях, берапрост, клопидогрел, эптифибатид, илопрост, тиклопидин, тирофибан усиливают риск развития кровотечения.
Способ применения и дозы
П/к (за исключением применения в процессе гемодиализа).
Данная форма предназначена для взрослых.
Нельзя вводить в/м!
1 мл Фраксипарина эквивалентен приблизительно 9500 МЕ анти-Ха факторной активности надропарина.
Техника п/к введения
Предпочтительно вводить пациенту в положении лежа, в подкожную ткань переднебокового или заднебокового брюшного пояса, поочередно с правой и левой стороны.
Иглу следует вводить перпендикулярно, (а не под углом), в защемленную складку кожи, держать между большим и указательным пальцем до конца введения раствора. Градуированные шприцы предназначены для подбора дозы в зависимости от массы тела больного.
Профилактика тромбоэмболии в хирургии
Частота применения. 1 инъекция в сутки.
Применяемая доза. Доза обусловлена индивидуальным уровнем риска, зависящем от массы тела больного и от типа операции.
Ситуации с умеренным тромбогенным риском. При хирургических операциях, представляющих умеренный тромбогенный риск, а также у больных без повышенного риска тромбоэмболии, эффективная профилактика тромбоэмболической болезни достигается введением дозы 2850 МЕ анти-Ха факторной активности в сутки (0,3 мл).
Начальная инъекция должна быть введена за 2 ч до хирургического вмешательства.
Ситуации с повышенным тромбогенным риском. Операции на бедре и колене: дозировка надропарина зависит от массы тела больного. Вводят 1 раз в сутки: 38 МЕ анти-Ха факторной активности/кг до операции, т.е. за 12 ч до процедуры, после операции, т.е. начиная с 12 ч после окончания процедуры, затем в сутки, до третьего дня после операции, включительно; 57 МЕ анти-Ха факторной активности/кг, начиная с четвертого дня после операции.
Прочие ситуации . В случаях, когда тромбоэмболический риск, связанный с типом операции (особенно при онкологических операциях) и/или с индивидуальными особенностями больного (особенно при тромбоэмболической болезни в анамнезе) кажется повышенным, достаточно бывает дозы 2850 МЕ анти-Ха факторной активности надропарина (0,3 мл).
Продолжительность лечения . Лечение НМГ, в комбинации с техникой традиционной эластичной компрессии нижних конечностей, должно продолжаться до полного восстановления двигательной функции больного.
В общей хирургии лечение НМГ должно продолжаться менее 10 дней, при отсутствии особого риска венозной тромбоэмболии, связанного с индивидуальными характеристиками больного (см. «Особые указания»).
Если риск тромбоэмболических осложнений присутствует по истечении рекомендованного срока лечения, необходимо продолжить профилактическое лечение, прежде всего с помощью пероральных антикоагулянтов.
Однако клиническая польза от длительного лечения низкомолекулярными гепаринами или антагонистами витамина К к настоящему времени не оценена.
Профилактика свертывания крови в системе экстракорпорального кровообращения при гемодиализе: интраваскулярно (в артериальный шунт петли диализа).
У больных, получающих повторные сеансы гемодиализа, профилактика коагуляции в экстракорпоральной петле очистки достигается путем введения начальной дозы 65 МЕ/кг в артериальную линию петли диализа в начале сеанса.
Эта доза, применяемая как однократная интраваскулярная болюсная инъекция, подходит только для сеансов диализа, продолжающихся не более 4 ч. Впоследствии доза может быть установлена в зависимости от индивидуальной реакции больного, которая изменяется в значительной степени.
Дозы, применяемые у больных, в зависимости от массы тела, следующие:
При необходимости, доза может быть изменена в соответствии с каждым индивидуальным случаем и с техническими условиями диализа. У больных с повышенным риском кровотечения сеансы диализа могут проводиться с использованием половинной дозы препарата.
Лечение тромбоза глубоких вен (ТГВ )
Любое подозрение должно сразу же быть подтверждено результатами соответствующих анализов.
Частота применения . 2 инъекции в сутки с промежутком 12 ч.
Применяемая доза . Доза каждой инъекции составляет 85 МЕ анти-Ха факторной активности/кг.
Дозировка НМГ не изучалась в зависимости от массы тела больных массой тела свыше 100 кг или ниже 40 кг. У больных с массой тела более 100 кг, эффективность НМГ может быть снижена. С другой стороны у больных с массой тела менее 40 кг, риск кровотечений может повышаться. В таких случаях требуется специальный клинический контроль.
Для данного показания доза, применяемая в зависимости от массы тела больного, составляет 0,1 мл/10 кг массы тела каждые 12 ч, как показано в следующей таблице:
| Масса тела больного, кг | Объем Фраксипарина на введение, мл |
| 40-49 | 0,4 |
| 50-59 | 0,5 |
| 60-69 | 0,6 |
| 70-79 | 0,7 |
| 80-89 | 0,8 |
| 90-99 | 0,9 |
| ≥100 | 1,0 |
Продолжительность лечения. Лечение НМГ следует быстро заменить пероральными антикоагулянтами, за исключением тех случаев, когда последние противопоказаны. Продолжительность лечения НМГ не должна превосходить 10 дней, включая период перехода на антагонисты витамина К (АВК), за исключением тех случаев, когда возникают трудности стабилизации МНО (см. «Особые указания»). Таким образом, лечение пероральными антикоагулянтами должно быть начато как можно раньше.
Лечение нестабильной стенокардии/инфаркта миокарда без изменения зубца Q
Частота применения. Надропарин кальция применяют в виде двух п/к инъекций в сутки (с промежутком в 12 ч), каждая в дозе 86 МЕ анти-Ха факторной активности, в комбинации с аспирином (рекомендованные дозы 75-325 мг внутрь, после вводной минимальной дозы 160 мг).
Применяемая доза. Начальную дозу следует вводить как в/в болюс в дозе 86 МЕ анти-Ха/кг, затем п/к в той же дозе.
| Масса тела больного, кг | Вводимый объем Фраксипарина | |
| Начальная доза (в/в, болюсно), мл | П/к инъекция каждые 12 ч, мл | |
| <50 | 0,4 | 0,4 |
| 50-59 | 0,5 | 0,5 |
| 60-69 | 0,6 | 0,6 |
| 70-79 | 0,7 | 0,7 |
| 80-89 | 0,8 | 0,8 |
| 90-99 | 0,9 | 0,9 |
| >100 | 1,0 | 1,0 |
Передозировка
Случайная передозировка при п/к введении больших доз низкомолекулярных гепаринов может вызывать кровотечение.
В случае приема внутрь — даже массированной дозы — низкомолекулярного гепарина (до сих пор не отмечалось) серьезных последствий ожидать не приходиться, учитывая очень низкую абсорбцию препарата.
Лечение: при малом кровотечении — отсрочить очередную дозу.
В некоторых случаях может быть показано применение протамина сульфата, при учете следующего: его эффективность значительно ниже, чем описанная в связи с передозировкой нефракционированного гепарина; отношение польза/риск протамина сульфата должно быть тщательно оценено, в связи с его побочными действиями (в особенности анафилактическим шоком).
Если решено применять такое лечение, нейтрализация проводится медленным в/в введением протамина сульфата.
Эффективная доза протамина сульфата зависит: от введенной дозы гепарина (100 антигепариновых единиц протамина сульфата могут быть использованы для нейтрализации активности 100 МЕ анти-Ха факторной активности НМГ); времени, прошедшего после введения гепарина, с возможным уменьшением дозы антидота.
Однако полностью нейтрализовать анти-Ха факторную активность невозможно.
Более того, кинетика абсорбции низкомолекулярного гепарина может придать этой нейтрализации временный характер и потребовать фрагментации полной рассчитанной дозы протамина сульфата на несколько инъекций (2-4), распределенных на сутки.
Особые указания
Несмотря на то что концентрацию различных препаратов низкомолекулярных гепаринов выражают в международных единицах анти-Ха факторной активности, их эффективность не ограничивается анти-Ха факторной активностью. Замена дозировочного режима одного НМГ другим опасна и недопустима, т.к. каждый режим был проверен специальными клиническими испытаниями. Поэтому необходима особая осторожность и соблюдение конкретных инструкций по применению для каждого лекарственного препарата.
Риск кровотечения. Необходимо соблюдать рекомендованные терапевтические режимы (дозировки и продолжительность лечения). В противоположном случае могут возникать кровотечения, особенно у больных групп риска (пожилые лица, пациенты, страдающие почечной недостаточностью и т.д.).
Серьезные кровотечения наблюдались: у пожилых больных, в особенности в связи с ослаблением функции почек с возрастом; при почечной недостаточности; у больных массой тела менее 40 кг; в случае продолжительности лечения, превышающей рекомендованную (10 дней); в случае несоблюдения рекомендованных условий лечения (в особенности продолжительности и установления дозы на основе массы тела для курсового применения); при комбинации с препаратами, усиливающими риск кровотечения.
В любом случае необходим особый контроль у пожилых больных и больных, страдающих почечной недостаточностью, а также при продолжительности применения препарата свыше 10 дней. Для выявления накопления препарата в некоторых случаях может быть полезно измерить анти-Ха факторную активность.
Риск гепарин-индуцированной тромбоцитопении (ГИТ). В случае, если у больного, получающего лечение НМГ (в курсовых или профилактических дозах), отмечаются: отрицательная динамика тромбоза, по поводу которого пациент лечится, флебит, эмболия легочных сосудов, острая ишемия нижних конечностей, инфаркт миокарда или инсульт, их следует рассматривать как манифестацию гепарин-индуцированной тромбоцитопении (ГИТ), и немедленно провести анализ числа тромбоцитов.
Применение у детей. Ввиду отсутствия данных, применение НМГ у детей не рекомендуется.
Функция почек. Перед началом лечения НМГ необходимо провести контроль функции почек, особенно у пожилых больных в возрасте старше 75 лет. Клиренс креатинина рассчитывают по формуле Кокрофта и на основе фактической массы тела больного: у мужчин Cl креатинина = (140-возраст) × масса тела / (0,814 × креатинин сыворотки), выражая возраст в годах, массу тела в кг, а креатинин сыворотки в мкмоль/л (если креатинин выражается в мг/мл, умножают на 8,8).
У женщин эта формула дополняется умножением результата на 0,85.
Выявление тяжелой почечной недостаточности (Cl креатинина около 30 мл/мин) составляет противопоказание применению НМГ в курсовой форме (см. «Противопоказания»).
Лабораторный контроль
Контроль числа тромбоцитов
Гепарин-индуцированная тромбоцитопения
В связи с опасностью развития ГИТ необходим контроль числа тромбоцитов, вне зависимости от показания для применения и назначенной дозы. Подсчет числа тромбоцитов проводят до начала лечения или не позже чем в течение первых суток после начала лечения, а затем 2 раза в неделю в течение всего курса лечения.
Диагноз ГИТ следует предположить, если число тромбоцитов <100000/мм 3 и/или наблюдается падение числа тромбоцитов на 30-50% по отношению к предыдущему анализу. Она развивается в основном между 5 и 21 днем после начала лечения гепарином (с максимальной частотой — около 10 дня).
Однако она может проявляться и значительно раньше при наличии в анамнезе больного тромбоцитопении, связанной с лечением гепарином, в очень редких случаях, и после 21 дня. Сбор такого анамнеза следует систематически проводить в ходе собеседования с больным до начала лечения. Кроме того, риск возникновения ГИТ при повторном введении гепарина может сохраняться в течение нескольких лет или даже неопределенного времени (см. «Противопоказания»).
В любом случае, возникновение ГИТ является неотложной ситуацией и требует консилиума со специалистом. Любое значительное падение числа тромбоцитов (на 30-50% от исходного значения) должно рассматриваться как сигнал тревоги еще до достижения критических значений. В случае падения числа тромбоцитов необходимо: немедленно проконтролировать число тромбоцитов.
Приостановить введение гепарина, если падение подтверждено или выявлено при этом контроле, в отсутствие других очевидных причин.
Отобрать образец крови в цитратную пробирку для проведения исследования агрегации тромбоцитов in vitro и иммунологического анализа. Однако в таких ситуациях неотложные меры не зависят от результатов этих анализов, поскольку эти анализы проводятся лишь несколькими специализированными лабораториями, и в лучшем случае результаты могут быть получены лишь по истечении нескольких часов. Несмотря на это анализы должны быть проведены для установления точного диагноза осложнения, т.к. при продолжении лечения гепарином риск тромбоза очень велик.
Осуществить профилактику и лечение тромботического осложнения ГИТ.
Если осложнение проявляется, необходимо продолжать антикоагулянтное лечение, гепарин должен быть заменен другим классом антитромботических ЛС : данапароидом натрия или гирудином, назначенным в профилактических или лечебных дозах, в зависимости от ситуации.
Замену на антагонисты витамина К можно проводить только после нормализации числа тромбоцитов, в связи с риском усиления тромботического эффекта.
Замена гепарина антагонистом витамина К . В этом случае следует усилить клинический и лабораторный контроль для наблюдения за эффектами антагониста витамина К.
Поскольку полное действие антагониста витамина К проявляется не сразу, гепарин следует продолжать вводить в эквивалентной дозе, пока это необходимо для достижения требуемого при данном показании уровня МНО в двух последовательных анализах.
Контроль анти-Ха факторной активности . Поскольку большинство клинических испытаний, продемонстрировавших эффективность НМГ, проводилось в дозах, установленных с учетом массы тела больного и без какого-либо особого лабораторного контроля, ценность такого типа контроля для оценки эффективности НМГ не установлена. Однако лабораторный контроль путем определения анти-Ха факторной активности может быть полезен при риске кровотечения в некоторых клинических ситуациях, часто сопряженных с опасностью передозировки.
Эти ситуации могут касаться показаний для курсового применения НМГ, в связи с примененными дозами, при слабой и умеренной почечной недостаточности (Cl , рассчитанный по формуле Кокрофта, 30-60 мл/мин): действительно, в противоположность нефракционированному стандартному гепарину, НМГ выводится в основном почками, и нарушенная функция почек может вести к относительной передозировке. Что касается тяжелой почечной недостаточности, она представляет собой противопоказание применению НМГ в курсовом режиме (см. «Противопоказания»); при экстремальной массе тела (пониженная масса тела или даже истощение, ожирение); при необъяснимом кровотечении.
В целях выявления возможной кумуляции после повторного введения рекомендуется брать кровь у больного по возможности при максимальной активности препарата (в соответствии с имеющимися данными), т.е.:
примерно через 4 ч после третьего введения, если препарат применяется в форме двух п/к инъекций в сутки или примерно через 4 ч после второго введения, если препарат применяется в форме одной п/к инъекции в сутки.
Повторное определение анти-Ха факторной активности для измерения уровня гепарина в сыворотке — каждые 2 или 3 дня — следует рассматривать в каждом отдельном случае, в зависимости от результатов предыдущего анализа, при необходимости модифицируя дозировку НМГ.
Для каждого НМГ и для каждого терапевтического режима генерируемая анти-Ха факторная активность различна.
В соответствии с показаниями и согласно имеющимся данным, средняя анти-Ха факторная активность (± стандартное отклонение), наблюдаемая на четвертом часу после введения надропарина в дозе:
83 МЕ/кг в виде двух инъекций в сутки, составляла 1,01±0,18 МЕ
168 МЕ/кг в виде одной инъекции в сутки, составляла 1,34±0,15 МЕ
Среднее значение наблюдалось в ходе клинических испытаний по определению анти-Ха факторной активности, проводившихся с использованием хромогенного (амидолитического) метода.
Активированное частичное тромбопластиновое время (АЧТВ ) . Некоторые НМГ умеренно удлиняют АЧТВ . (Не имеет клинической значимости).
Проведение спинно-мозговой/эпидуральной анестезии в случае профилактического применения НМГ . При применении НМГ, а также других антикоагулянтов, в ходе спинномозговой или эпидуральной анестезии, отмечались редкие случаи интраспинальной гематомы, ведущей к длительному или стойкому параличу.
Риск интраспинальной гематомы, по-видимому, более высок при использовании эпидурального катетера, чем при применении спинно-мозговой анестезии.
Опасность возникновения этого редкого осложнения может увеличиваться при длительном применении эпидурального катетера после хирургического вмешательства.
Если предоперационное лечение НМГ необходимо (длительная иммобилизация, травма), а преимущества спинно-мозговой анестезии тщательно оценены, эту технику можно применить у больного, получившего до операции инъекцию НМГ, если между инъекцией гепарина и применением спинно-мозгового анестетика прошел период не менее 12 ч. В связи с опасностью возникновения интраспинальной гематомы необходим тщательный неврологический контроль.
Почти во всех случаях профилактическое лечение НМГ может быть начато в течение 6-8 ч после применения анестетика или извлечения катетера, при неврологическом контроле.
Особая осторожность требуется в случае комбинации с другими препаратами, влияющими на гемостаз (а именно НПВС , ацетилсалициловая кислота).
Не влияет на способность управлять автомобилем и работать на станках.
Использование системы защиты иглы: после введения препарата применять систему безопасности для шприца Фраксипарина. Удерживая использованный шприц в одной руке за защитный корпус, другой рукой тянут за держатель для высвобождения защелки и сдвигания чехла для защиты иглы до щелчка. Использованная игла полностью защищена.
Производитель
Санофи Винтроп Индустрия, Франция.
Условия хранения препарата Фраксипарин
При температуре не выше 30 °C.Хранить в недоступном для детей месте.
Срок годности препарата Фраксипарин
3 года.Не применять по истечении срока годности, указанного на упаковке.
Синонимы нозологических групп
| Рубрика МКБ-10 | Синонимы заболеваний по МКБ-10 |
|---|---|
| I20.0 Нестабильная стенокардия | Болезнь Гебердена |
| Нестабильная стенокардия | |
| Стенокардия нестабильная | |
| I21.9 Острый инфаркт миокарда неуточненный | Изменения левого желудочка при инфаркте миокарда |
| Изменения левого предсердия при инфаркте миокарда | |
| Инфаркт миокарда | |
| Инфаркт миокарда без зубца Q | |
| Инфаркт миокарда без признаков хронической сердечной недостаточности | |
| Инфаркт миокарда при нестабильной стенокардии | |
| Пируэтная тахикардия при инфаркте миокарда | |
| I82.9 Эмболия и тромбоз неуточненной вены | Венозная эмболия |
| Венозный тромбоз | |
| Заболевания, обусловленные образованием тромбов в сосудах | |
| Острая васкулярная окклюзия | |
| Острый венозный тромбоз | |
| Острый тромбоз вен | |
| Тромбоз | |
| Тромбоэмболия | |
| Флеботромбоз | |
| Эмболизм | |
| Z49.1 Помощь, включающая экстракорпоральный диализ | Гемодиализ |
| Тромбоз гемодиализного шунта | |
| Хронический гемодиализ | |
| Экстракорпоральное кровообращение |
Низкомолекулярные гепарины (НМГ)
антикоагулянт гирудин кровь активатор
Результаты клинических исследований свидетельствуют об эффективности применения гепарина при остром инфаркте миокарда, нестабильной стенокардии, тромбозе глубоких вен нижних конечностей и некоторых других состояниях. Однако невозможность с точностью предсказать выраженность антикоагулянтного эффекта требует регулярного и частого проведения лабораторных исследований для определения времени свертывания крови или активированного частичного тромбопластинового времени. Кроме того, гепарин обладает побочными эффектами, в частности он способен вызывать остеопороз, тромбоцитопению, а также способствует агрегации тромбоцитов. В связи с этим были разработаны низкомолекулярные гепарины (НМГ), выделенные из «нефракционированного» гепарина.
С химической точки зрения гепарин представляет собой смесь полимеров, состоящих из остатков сахаридов, молекулярная масса которых колеблется в пределах 5000-30 000 Д. Молекулы такого полимера имеют места связывания с антитромбином плазмы крови -- определенная пентасахаридная последовательность.
Рис.1.
При взаимодействии гепарина с антитромбином активность последнего резко возрастает. Это создает предпосылки для подавления каскада реакций свертывания крови, благодаря чему и реализуется антикоагулянтное действие гепарина. Необходимо отметить, что «нефракционированный» гепарин содержит полимеры с различной длиной цепи. Небольшие по размеру молекулы гепаринов усиливают антикоагулянтное действие за счет подавления активности фактора Ха, однако они не способны усиливать эффект антитромбина, направленный на угнетение фактора свертывания крови Па. В то же время гепарины с большей длиной цепи повышают активность антитромбина в отношении фактора Па. Гепарины, которые активируют антитромбин, составляют третью часть таковых, входящих в состав «нефракционированного» гепарина.
Таким образом, с химической точки зрения НМГ являются гетерогенной смесью сульфатированных гликозаминогликанов. Лекарственные средства на основе НМГ имеют ряд преимуществ по сравнению с «нефракционированным» гепарином. Так, при их использовании можно с большей точностью предсказать дозозависимый антикоагулянтный эффект, они характеризуются повышенной биодоступностью при подкожном введении, более продолжительным периодом полураспада, низкой частотой развития тромбоцитопении, кроме того, нет необходимости регулярно проводить определение времени свертывания крови или активированного частичного тромбопластинового времени.

Рис. 2.
Таблица 1
Сравнительная характеристика НФГ и НМГ
Все НМГ имеют схожий механизм действия, но различная молекулярная масса обусловливает разную их активность в отношении фактора свертывания Ха и тромбина, а также различное сродство к белкам плазмы крови.
Препараты НМГ различаются по химической структуре, методам получения, периоду полураспада, специфическому действию, и поэтому они не могут быть взаимозаменяемыми. НМГ получают путем деполимеризации гепарина, выделенного из слизистых оболочек свиньи различными методами. Например, дальтепарин получают методом деполимеризации с использованием азотистой кислоты, эноксапарин -- методом бензилирования с последующей щелочной деполимеризацией, для получения тинзапарина используют метод ферментативного расщепления «нефракционированного» гепарина с помощью гепариназы. Применяя различные способы деполимеризации, получают НМГ различной химической структуры с различным количеством мест связывания с антитромбином, а также других функциональных химических групп, которые принимают участие в реакциях противосвертывающей системы крови. В связи с тем что НМГ отличаются по своей химической структуре, соответствующие препараты данного ряда проявляют специфическую активность в отношении фактора свертывания Ха.
Необходимо также отметить, что препараты НМГ обладают различной биодоступностью, поэтому режим дозирования, способ введения и показания к применению каждого из них несколько отличаются. Иными словами, препараты НМГ не являются взаимозаменяемыми, их необходимо применять в соответствии с утвержденными показаниями.

Рис.3.
Таблица 2
Фармакологические и клинические эффекты низкомолекулярных гепаринов
|
Мишень действия НМГ |
Тромбин, белки, макрофаги, тромбоциты, остеобласты |
|
Фармакологические свойства |
Снижение активности фактора свертывания IIа; повышенная биодоступность; предсказуемый антикоагулянтный эффект; быстрая клубочковая фильтрация; низкая частота выработки антител к НМГ; незначительная активация остеобластов |
|
Особенности применения |
НМГ эффективны при подкожном способе введения; не требуют регулярного определения времени свертывания крови или активированного частичного тромбопласти- нового времени; продолжительный период полураспада; терапевтический эффект проявляется при приеме 1 раз в сутки; низкая частота развития тромбоцитопении, вызванной гепарином; низкая частота развития остеопороза. |
Наряду с опосредованными антитромбином эффектами НМГ оказывают несвязанное с антитромбином действие, в частности вызывают выделение тканевого ингибитора тромбопластина, подавляют освобождение фактора фон Виллебранда (секретируется тромбоцитами и эндотелиальными клетками и вызывает агрегацию тромбоцитов), устраняют прокоагулянтную активность лейкоцитов, улучшают эндотелиальную функцию и др.
В настоящее время в клинической практике с целью профилактики и лечения тромбозов используется около 10 наименований НМГ. Каждый из них имеет свой уникальный спектр антитромботического действия, что определяет профиль клинической эффективности. В таблице 3 представлена сравнительная характеристика зарегистрированных и применяемых в России препаратов данной группы .
Таблица 3
Сравнительная характеристика низкомолекулярных гепаринов
НМГ -- современные эффективные лекарственные средства для лечения и профилактики различных тромбоэмболических состояний. НМГ действуют на различные механизмы системы свертывания крови, а также оказывают положительное влияние на клетки крови и эндотелия, ослабляя их проагрегантные свойства. Несомненное преимущество препаратов данного фармакологического ряда -- отсутствие необходимости регулярного и частого взятия крови для определения времени свертывания крови и активированного частичного тромбопластинового времени.